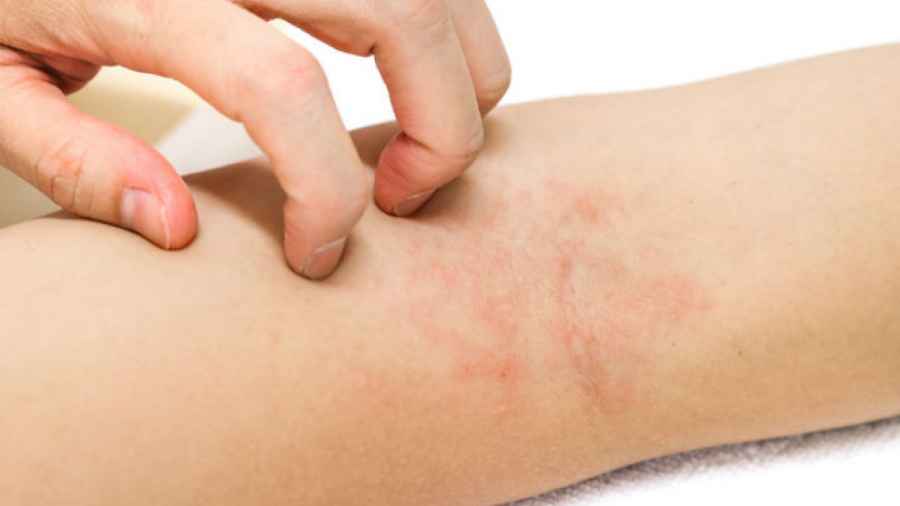
Campaña de detección gratuita de Dermatitis Atópica
La dermatitis atópica es una enfermedad inflamatoria y crónica de la piel, caracterizada por brotes frecuentes, picazón intensa, irritación, dolor, enrojecimiento, costras e infecciones. Las lesiones pueden ubicarse en la cara, el cuero cabelludo, las orejas, el dorso de las manos y las zonas de flexión de las extremidades.
"Se estima que es la tercera enfermedad de prevalencia en la infancia y que su incidencia se triplicó en los últimos 30 años. Afecta del 15 al 30 por ciento de los niños y del 1 al 3 por ciento de los adultos dependiendo de la población considerada. La piel tiende a estar seca con una tendencia a generar eczemas y a picar. No siempre está igual o estable, está en la naturaleza de la dermatitis atópica volver. Se presenta en forma de brotes y remisiones. No podemos curarla, pero tenemos la posibilidad de mejorarla y hacer muchas cosas para tenerla bajo control y que moleste lo menos posible", explicó la doctora Paula Luna, médica especialista en Dermatología y Dermatología Infantil del Hospital Alemán, integrante de la Comisión Directiva de SOARPSO, MN. 110.953.
Es una enfermedad multifactorial en la que intervienen factores genéticos, ambientales, alteraciones inmunológicas y problemas en la función de barrera de la piel. Existen otras enfermedades desencadenadas por el mismo proceso inflamatorio, donde el sistema inmunológico de los pacientes está sobreactivado y genera procesos inflamatorios sistémicos. Por ello, es muy frecuente que la dermatitis coexista con otras enfermedades alérgicas, como asma, rinoconjuntivitis, alergia alimentaria, entre otras.
"La dermatitis atópica es una enfermedad que muchas veces tiene un perfil alérgico. En los primeros años puede aparecer solo como dermatitis, pero luego desarrollar otras manifestaciones alérgicas como la alimentaria, la rinitis o el asma. Estas enfermedades asociadas no deben descuidarse porque si, por ejemplo, no tratamos su asma su función pulmonar se verá afectada, si no tratamos su rinitis alérgica o alergia alimentaria toda su calidad de vida se verá afectada", afirmó el doctor Maximiliano Gómez, especialista en alergia e inmunología y presidente de la Asociación Argentina de Alergia e Inmunología Clínica (AAAeIC), MN 174.006.
En este sentido, es fundamental un abordaje multidisciplinario de la enfermedad en el que intervengan diferentes profesionales. "La visión del dermatólogo y del alergólogo se complementan y el paciente se beneficia del cuidado integral, de su piel y de su alergia. Trabajar en conjunto garantiza una evaluación y un tratamiento especializado y complementario, en beneficio del paciente" agregó Gómez.
El diagnóstico a tiempo es el primer paso para poder cambiar el rumbo de una enfermedad, las nuevas herramientas terapéuticas disponibles en la actualidad permiten mejorar sustancialmente la calidad de vida de los pacientes. "Hasta hace un tiempo, no teníamos muchas herramientas para tratarla; actualmente hay más tratamientos disponibles, medicamentos modernos que son los últimos aprobados específicamente para esta enfermedad, desde biológicos (inhibidores de las interleuquinas 4 y 13) disponibles desde hace varios años la Argentina, hasta tratamientos orales (inhibidores de JAK) recientemente aprobados. Estos tratamientos tienen como objetivo controlar la picazón y las lesiones cutáneas de los pacientes con dermatitis atópica de moderada a grave. Otros se encuentran en etapas avanzadas de investigación. Los pacientes cada vez están mejor y cuando existen varias y mejores opciones terapéuticas, a los médicos también nos entusiasma" detalló Luna.
"El diagnóstico a tiempo, permite el tratamiento apropiado e individualizado del paciente, contribuir al alivio en aquellos casos con enfermedad más grave y avanzada, identificar y tratar, de ser necesario, las comorbilidades asociadas y en los casos leves, evitar la progresión del eczema", aseguró la doctora María Eugenia Abad, presidenta de la Sociedad de Dermatología Pediátrica para Latinoamérica (SDPL), MN 87054.
Cerca del 90% de los pacientes ve afectada diariamente su calidad de vida, la dermatitis atópica impacta en los ámbitos laboral, escolar, social, vincular y económico. "La piel atópica se convierte en una barrera social, condiciona desde la vestimenta hasta los vínculos y esto definitivamente daña la autoestima. Las personas que la atraviesan sienten frustración, enojo, alteración del ánimo, estrés, trastornos del sueño, modificaciones en su rutina y dolor" describió Mariana Palacios, presidenta de la Asociación Dermatitis Atópica Argentina (ADAR).
La picazón, principal síntoma de la enfermedad, no es un aspecto menor, las personas a las que la piel les pica en forma crónica e intensa tienen el triple de posibilidades de desarrollar depresión y el doble de experimentar ansiedad. "La picazón es intensa y sucede en contextos o situaciones imposibles de controlar: en la escuela, en el trabajo, en un transporte público, en un evento social o al intentar dormir" amplió Silvia Fernández Barrio, presidenta de AEPSO. Cuando los pacientes califican la intensidad de su picazón en un rango del 1 al 10, el promedio general asciende a 7.8."Las enfermedades de la piel no son cosméticas, son afecciones con un enorme impacto en la vida de las personas, en su salud mental y en su bienestar, tanto personal como de todo su entorno y no debemos olvidar el desgaste a causa de la burocracia de nuestro sistema de salud al que nos enfrentamos para poder acceder a tratamientos más eficaces", concluyó.
Según recientes relevamientos, existe una dificultad para acceder al diagnóstico correcto, especialmente en localidades alejadas del área metropolitana. Dependiendo del lugar del país se identifican provincias donde 6 de cada 10 diagnósticos pueden demorar de 2 a 5 años[5]. "Acercar estas campañas a todo el país nos parece un aporte fundamental para que muchas de las personas que aún deambulan de médico en médico puedan tener un diagnóstico y un tratamiento correcto que les permita un mayor control de la enfermedad" coincidieron desde ambas organizaciones.
Campaña gratuita de detección
Organizada por la Asociación Dermatitis Atópica Argentina (ADAR), la Asociación Civil para el Enfermo de Psoriasis (AEPSO), la Sociedad Argentina de Psoriasis (SOARPSO), la Asociación Argentina de Alergia e Inmunología Clínica (AAAeIC) y la Sociedad de Dermatología Pediátrica para Latinoamérica (SDPL), se llevará adelante una nueva campaña de detección gratuita de dermatitis atópica, con el objetivo de promover el diagnóstico temprano y mejorar la calidad de vida de las personas que deben atravesar esta enfermedad.
Desde el 7 y hasta el 11 de noviembre se realizará una semana de asignación de turnos a través de www.pedirturno.com.ar o llamando al 0800 222 3776, de lunes a viernes, de 9 a 14 hs. La atención efectiva se realizará del 14 al 18 de noviembre.
Participan profesionales de diferentes provincias y ciudades de todo el país.
Prevenir como objetivo
La fiebre del dengue es causada por uno de los cuatro virus relacionados que se transmiten a través de ciertas especies de mosquitos como Aedes Aegypti, que generalmente pica durante el día. Según la OMS, al menos 390 millones de personas se infectan cada año con esta enfermedad y se estima que 3.9 mil millones de personas se encuentran en potencial riesgo de contraer el virus del dengue.
Los mosquitos usan múltiples señales para detectar la sangre: los químicos en nuestro aliento y respiración, el calor corporal e incluso la ropa de colores oscuros. La variación individual en la química corporal hace que algunas personas sean más propensas a atraer mosquitos que otras.
Datos relevantes
Según la Organización Mundial de la Salud (OMS), las enfermedades transmitidas por vectores representan más del 17% de todas las enfermedades infecciosas y provocan más de 700.000 muertes por año. Dengue, Zika y Chagas son algunas de las enfermedades que transmiten los insectos. Las dos primeras son motivo de alerta permanente por parte de los organismos de salud globales, con especial énfasis en territorio argentino.
“Los repelentes e insecticidas son centrales en las estrategias de prevención de enfermedades de transmisión por vectores”
La OMS en Respuesta Mundial para el Control de Vectores 2017-2030 reconoce al uso de repelentes de uso personal y de los insecticidas para el hogar como elementos de probada eficacia en el control de enfermedades de transmisión por vectores.
Portafolio OFF
Los productos OFF!® disponibles en Argentina incluyen una variedad de cremas, aerosoles, geles y sprays. El tipo de producto debe elegirse en función de las preferencias de los consumidores. Todos los repelentes personales de la línea OFF!® repelen eficazmente a los mosquitos, incluidos los que pueden transmitir el virus del dengue.
Los repelentes de la marca OFF!® están compuestos por los siguientes activos:
- DEET es el nombre común del N,N-diethil-m-toluamida, el repelente más reconocido a nivel mundial utilizado desde 1946. El DEET no mata a los mosquitos, sino que los disuade y repele si es aplicado de manera correcta. Su uso es apropiado en niños a partir de 2 años siempre y cuando que el producto contenga DEET en menos de un 10%. En concentraciones mayores al 10% se puede utilizar a partir de 12 años.
El nivel de DEET en el repelente determina cuánto dura la protección. Asimismo, la durabilidad de la protección también se encuentra relacionada con la consistencia del producto. Por ejemplo, un producto que contiene 7,5% de DEET repele los mosquitos hasta por 4 horas (por ejemplo: OFF!® Crema Family), mientras que los productos de OFF!® aerosol que cuentan con un 25% de DEET repelen por hasta 12 horas (aplicados correctamente según las indicaciones del etiquetado), tal es el caso de los Extra Duración.
- Icaridina: En la década del 80, nació la ICARIDINA, convirtiéndose en el segundo activo repelente, después del DEET, recomendado por la OMS. Dentro de Argentina, también lo recomienda la Sociedad Argentina de Pediatría.
¿Cómo funciona? Forma como una barrera de vapor que disuade a los mosquitos para posarse sobre la piel. No tiene ni olor ni color, se puede aplicar en piel y ropa sin riesgo de que este se mancha.
Este activo es igual de efectivo que el DEET, y no deja una sensación grasosa en la piel.
La línea OFF!® Defense Infantil posee dos variantes en el mercado: Spray, autorizado para niños a partir de los 2 años, y el formato Gel, que puede ser aplicado a partir de los 3 meses de edad.
“Año tras año, OFF!® renueva su compromiso con la salud pública y la comunidad en tanto busca proveer a la ciudadanía de los insumos necesarios para hacer frente a las enfermedades transmitidas por mosquitos, a la vez que refuerza la intención de capacitar y educar a la comunidad en general acerca del correcto uso de sus productos”
Aprueban en el país el uso de una medicación para el asma grave en niños
El asma afecta a más del 12% de los niños en nuestro país y entre un 5 y un 10% de ellos presenta la variante grave de la enfermedad que corresponde a los cuadros que no logran ser adecuadamente controlados con dosis elevadas de los tratamientos habituales (corticoides inhalados en dosis máximas, sumados a uno o más broncodilatadores de larga duración).
El asma grave representa mayor severidad de los síntomas, por lo que se asocia a peor calidad de vida, más ausentismo escolar, necesidad de mayor asistencia por parte de familiares o cuidadores, más visitas de urgencia a la guardia, más internaciones y un incremento sustancial de los costos asociados al cuidado de su salud.
Tal como describió el Dr. Alejandro Teper, médico neumonólogo, Jefe del Centro Respiratorio del Hospital de Niños 'Ricardo Gutiérrez', "los pacientes con asma grave requieren utilizar varios medicamentos para poder controlar sus síntomas y, aun así, en muchas ocasiones no lo logran. Son niños que se hospitalizan frecuentemente, deben ausentarse de la escuela en muchas ocasiones y experimentan una limitación para realizar ejercicios físicos.
Para los pacientes con este grado de asma, existe una nueva opción terapéutica disponible en nuestro país, ya que la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) aprobó el uso de dupilumab en niños de 6 a 11 años como tratamiento de mantenimiento complementario para el asma severa causada por el mecanismo denominado inflamación de tipo 2, que no se controla adecuadamente con dosis altas de corticoides inhalados, más otro medicamento para tratamiento de mantenimiento. Hasta el 85% de los niños con asma presentan inflamación de tipo 2.
Este medicamento ya había demostrado beneficios en el tratamiento de adultos y de adolescentes entre 12 y 17 años con este tipo de asma, aprobación que obtuvo en 2021.
En el estudio clínico Liberty Asthma Voyage, el dupilumab, que es un anticuerpo monoclonal inyectable, demostró reducir hasta un 65% las exacerbaciones, que son episodios agudos, angustiantes e impredecibles de ataques de tos, falta de aire y sensación de opresión en el pecho, que pueden terminar en una internación.
"Menos exacerbaciones representan una vida más tranquila y sin sobresaltos por el asma, pero también se traduce en menos necesidad de recurrir al uso de corticoides sistémicos, que suelen administrarse ante las urgencias cuando se debe acudir a la guardia. Esto es relevante porque está demostrado que más de dos cursos anuales de corticoides aumentan la posibilidad de contraer o agravar enfermedades crónicas como diabetes, osteoporosis, hipertensión arterial u obesidad, entre otras. Por lo tanto, debemos procurar nuevas estrategias que ayuden a evitar su uso frecuente", explicó el Dr. Jorge Máspero, médico especialista en Alergia e Inmunología Clínica, Director Médico de Fundación CIDEA, quien participó como investigador por Argentina del estudio Liberty Asthma Voyage.
Entre otros resultados de la investigación, se destaca también que casi 8 de cada 10 niños que recibieron dupilumab no experimentaron exacerbaciones en todo el año que duró el estudio, contra 6 de 10 entre los participantes que recibieron la terapia estándar. Además, en ambas ramas del estudio, quienes recibieron dupilumab y en algún momento sufrieron exacerbaciones, habían logrado estar libres de ellas por más tiempo que el resto.
Argentina será sede de una cumbre médica mundial sobre la Hemofilia
Con un acto realizado en la sede de la Fundación de la Hemofilia, se anunció oficialmente la realización de una Cumbre en la Argentina que tendrá como organizadora a la Federación Mundial de la Hemofilia (FMH) y como anfitrión a la Fundación de la Hemofilia.
La misma, denominada 'Cumbre de la FMH sobre atención integral: Nuevos avances en trastornos de la coagulación y temas musculoesqueléticos', se realizará en Buenos Aires, en la sede de la Fundación, los días 10, 11 y 12 de mayo de 2023, y contará con la presencia de destacados especialistas de nuestro país y del mundo.
En opinión de la Dra. Daniela Neme, médica hematóloga, directora médica de la Fundación de la Hemofilia, "la Cumbre ofrecerá una revisión actualizada del manejo hematológico, musculoesquelético y multidisciplinario del paciente con hemofilia. Nos permitirá conocer los nuevos tratamientos disponibles y los que se encuentran aún en fase de investigación, que serán una herramienta más para un tratamiento más adecuado ajustado a la necesidad de cada paciente".
La Cumbre de la FMH sobre atención integral reunirá a profesionales médicos, personas con trastornos de la coagulación y defensores de la comunidad para abordar nuevas investigaciones y descubrimientos médicos, así como para valorar problemas y cuestiones presentes en el tratamiento de los trastornos de la coagulación en diferentes partes del mundo.
Durante tres días, los participantes disfrutarán de más de 30 horas de sesiones educativas continuas en tres temas: musculoesquelético, médico y multidisciplinario, todos centrados en novedades relacionadas con los avances más recientes en el campo de los trastornos de la coagulación y atención y tratamiento musculoesqueléticos.
Participarán oradores de clase mundial en plenarias y sesiones, y los participantes podrán acceder a sesiones interactivas, paneles de discusión y simposios innovadores de la industria. Los participantes también tendrán la oportunidad de obtener créditos de 'Educación Médica Continua (CME)'.
Durante el acto de presentación de este encuentro internacional, destacadas autoridades invitadas del ámbito académico y científico aprovecharon también para celebrar los 78 años de vida de la Fundación de la Hemofilia, primera organización en el mundo creada para brindar atención integral a personas con hemofilia y para la investigación de la enfermedad. La Fundación se creó bajo el auspicio de la Academia Nacional de Medicina el 26 de octubre de 1944.
El Robot BD Rowa y la ventaja en la gestión automática de medicamentos
En un mundo signado por los avances tecnológicos constantes, los responsables de farmacias y establecimientos de venta de fármacos buscan incorporar herramientas innovadoras que les permitan mejorar su operatoria. Becton Dickinson (BD), una de las mayores empresas globales de tecnología médica que impulsa el mundo de la salud, ofrece al mercado local su portafolio de robots de origen alemán, especializados en la automatización del almacenamiento y dispensación de medicamentos en farmacias comerciales y hospitalarias. A la fecha se han instalado 11. 000 robots BD Rowa™ en 53 países: de éstos, más de 120 se han comercializado en Argentina, siendo el país con mayor número de robots vendidos e instalados en América Latina.
Gracias a la utilización de robots, el sector farmacéutico optimiza recursos económicos, disminuye los tiempos de dispensación y los errores humanos, y gana más espacio físico para comercializar otros productos", explica Juan Pablo Rodríguez, Gerente del Negocio de Soluciones para la Gestión de la Medicación para Cono Sur de Becton Dickinson. "También impacta positivamente en un óptimo control del stock, ya que es mayor el control sobre el vencimiento de los productos y representa una mejor experiencia para el cliente, porque quien los atiende no se retira del mostrador para buscar el producto". Estos robots reducen hasta en 28% el tiempo dedicado a la colocación del producto en góndola y en 33% el lapso invertido en su búsqueda. Además, incrementan en 7,3% las ventas en farmacias, al tiempo que garantizan 14% más espacio de exposición de producto.
La incorporación de la tecnología Rowa™, en primera persona
Eduardo es dueño de la farmacia "Gutkind" de Del Viso, Provincia de Buenos Aires, y se reconoce como "un fanático de la eficiencia". En 2021 instaló el BD Rowa™ porque "buscaba una disminución de los tiempos de atención. En la farmacia cuento con un software de gestión que me permite medir el tiempo de espera (desde que el paciente entra y saca el número hasta que es atendido) y el de atención. En el modelo clásico de farmacia, la experiencia del paciente consta de unos 12 - 14 minutos, promedio, en total. Yo venía trabajando en este tema y la gente estaba 5 minutos en la farmacia. Hoy está 4 minutos: con el robot logré una reducción del 20% del tiempo de atención porque mejoró la eficiencia. Y en el boca a boca de la gente se está instalando que la atención en nuestra farmacia es muy rápida" describe Gutkind.
A través de un brazo mecánico, el robot ordena los medicamentos en su interior, maximizando la capacidad de almacenaje efectivo y optimizando el espacio al máximo. Cuando llega el momento de la expedición, la pinza patentada en V puede tomar hasta 4 envases aproximadamente a la vez y dispensar medicamentos en cuestión de segundos. Los robots simplifican el control de existencias de producto y garantizan la reducción de quiebres de stock, al mismo tiempo que brindan la posibilidad de monitorear fechas de vencimiento.
"Otra de las ventajas es que la atención mejoró sustancialmente porque las personas que trabajan no tienen que retirarse del mostrador para ir a buscar los medicamentos, entonces no se interrumpe la comunicación con el cliente" describe Gutkind y agrega: "Es importante que cuando el cliente ingrese a la farmacia vea poca gente esperando o que tenga la sensación de que lo van a atender rápido. Sino se va a otro lugar, porque la gente no quiere esperar. Con el robot, se puede tener a todos los empleados dedicados a la atención".
A su vez, con la automatización, el ingreso de mercadería al sistema es de 3 segundos por producto. Una vez colocado en el sistema, el insumo ya está disponible para la venta. De esta forma, los robots liberan al personal de verificar el stock, controlar los vencimientos y guardar los productos, optimizando así su jornada de trabajo. Al hacerlo, reducen el tiempo de ejecución de las tareas administrativas, los esfuerzos en búsquedas de insumos y los posibles errores de dispensación y guardado.
"Es importante destacar que la incorporación de estas tecnologías no implica grandes refacciones del espacio ni costos asociados, ya que se trata de un instrumento versátil que puede ubicarse tanto en el piso superior como en la planta baja o el sótano. La elección dependerá de la disposición de cada local. Incluso, este tipo de tecnología es sumamente versátil y puede instalarse en las farmacias de clínicas u hospitales", describe Rodríguez. "Además, contamos con un servicio técnico local certificado que trabaja para garantizar que el sistema funcione de manera óptima, tanto a nivel técnico como organizativo, realizando visitas periódicas a nuestros clientes y brindando una asistencia remota, las 24 horas del día, los siete días de la semana, que resuelve el 98% de los incidentes" concluye.
Día Mundial del Ataque Cerebral
Con motivo de conmemorarse el 29 de octubre el Día Mundial del Ataque Cerebral, la Federación Argentina de Cardiología (FAC) brinda información para continuar con la campaña de concientización:
- Cada 9 minutos se produce un ACV
- Se producen 14 millones de ataques cerebrales en el mundo por año
- 5,5 millones de personas fallecen por esta enfermedad
- 2 de cada 3 de ellos vivirán con alguna forma de discapacidad
- En Argentina es la tercera causa de muerte, después de la enfermedad coronaria y la gripe/neumonía
- En 2020 se produjeron 22.878 muertes, 8,27% de todas las muertes
Las buenas noticias son que el 80% de los accidentes cerebrovasculares pueden prevenirse. Parte de los siguientes consejos podrán partir desde la Farmacia:
- Controlar la hipertensión arterial
- Dieta equilibrada y baja en grasas
- No fumar
- No ingerir alcohol en exceso
Espasticidad, secuela común del ACV
Se estima que, en la Argentina, se produce un accidente cerebrovascular (ACV) cada 9 minutos y constituye la primera causa de discapacidad permanente en las personas adultas. Las secuelas son varias y cada una requiere un tratamiento específico, pero tratarlas de forma temprana permite evitar la discapacidad a largo plazo.
La espasticidad constituye una secuela motora importante del ACV, se estima que entre el 20 y el 30 por ciento de las personas que han sufrido un accidente cerebrovascular (ACV) pueden desarrollarla. Los estudios muestran que, entre los 3 y 18 meses posteriores a un ACV, las lesiones cerebrales pueden causar un cambio en la remodelación muscular que conduzca a desarrollar una forma grave de espasticidad. Sin tratamiento, en general, a los 3 meses el 27% de los pacientes ha desarrollado espasticidad y a los 6 meses esa secuela ya afecta al 58% (15% de ellos en forma grave). Sin embargo, las herramientas diagnósticas de las que se disponen actualmente permiten pronosticar el desarrollo de la espasticidad con alta sensibilidad y especificidad, dando lugar a su tratamiento precoz.
La espasticidad es un trastorno motor del sistema nervioso que genera un aumento del tono muscular y afecta la movilidad de los pacientes. “Afecta la postura y el movimiento. Puede presentarse en niños o adultos, dependiendo de la causa o lesión que la provoca. Si bien es una condición desconocida por muchos, es muy frecuente en pacientes con lesión neurológica. Se observa en niños con parálisis cerebral, en personas que han sufrido un ACV, o una lesión medular o encefalocraneana, o presentan una enfermedad neurológica como esclerosis múltiple” detalló la Dra. Mercedes Molinuevo (MN. 92810), médica especialista en Medicina Física y Rehabilitación y Presidenta de la Sociedad Argentina de Medicina Física y Rehabilitación (SAMFyR).
La espasticidad es una condición que, si no es tratada a tiempo, ocasiona la pérdida de la capacidad funcional en general e impacta notablemente en la calidad de vida. “Puede ocasionar dificultades para el desarrollo de las actividades de la vida y rutina diaria como vestirse, higienizarse, alimentarse, entre muchas otras. Puede también generar dolor crónico, trastornos para conciliar el sueño y, en algunos casos, generar un síndrome depresivo”, afirmó el Dr. Gastón Espinet (MN 134778), médico especialista en Medicina Física y Rehabilitación, miembro de la comisión directiva de SAMFYR, Director Posgrado Manejo de la Espasticidad (SAMFYR), médico fisiatra en ALPI y Centro Fintea.
Tras un ACV, lo primero que debe hacer un paciente es recibir atención de manera inmediata para poder reconocer y evaluar el cuadro. En una primera etapa, la etapa de la urgencia en la que el paciente arriba al centro de salud, es atendido por el médico de terapia intensiva y el neurólogo. Una vez estabilizado, requiere de una atención y equipo multidisciplinario. Aquí intervienen fisiatras, fonoaudiólogos, terapistas ocupacionales, kinesiólogos, que trabajan conjuntamente con el médico neurólogo.
En el caso de la espasticidad como secuela, si bien es una condición que no tiene cura, tiene un tratamiento que permite reducir su impacto. “Existen distintas opciones terapéuticas para tratarla y evitar o disminuir las complicaciones que conlleva. Requiere control y tratamiento interdisciplinario por parte de médicos fisiatras, equipos de rehabilitación, kinesiólogos, terapistas ocupacionales, fonoaudiólogos. El uso de medicación miorrelajante, toxina botulínica, uso de férulas, terapias de rehabilitación para mejorar los patrones de movimiento”, explicó la Dra. Molinuevo.
La espasticidad en sí misma no puede prevenirse, pero una vez instaurada la lesión neurológica lo que se puede hacer es evitar que empeore. “Es importante la detección temprana y no demorar el tratamiento porque, al ser una condición que no tiene cura y es crónica, tiende a empeorar si no se la trata de forma oportuna y correcta” explicó el Dr. Espinet que también aclaró, “El médico fisiatra puede ser consultado directamente sin necesidad de derivación. Debemos tomar conciencia de la importancia del tratamiento temprano de las secuelas, ya que esto permite reducir su impacto y que el paciente pueda alcanzar una mejor calidad de vida”.
Drogas para la diabetes evitan alto porcentaje de muertes en pacientes cardiológicos
El principal tema que concitó el interés de los cerca de 10 mil participantes del Congreso Argentino de Cardiología (SAC.22) fueron los resultados presentados con un nuevo grupo de drogas utilizadas tradicionalmente para tratar a pacientes con diabetes tipo 2, pero que además demostraron reducir la mortalidad, las hospitalizaciones y el tiempo de las mismas en pacientes con insuficiencia cardíaca (IC), mejorando significativamente también su calidad de vida. La IC es un síndrome clínico que representa la etapa avanzada de varias cardiopatías, entre ellas, las valvulopatías, miocardiopatías y cardiopatías congénitas; extrapolando estadísticas internacionales se estima que afecta al 1,5% de la población Argentina, lo que representaría más de 700 mil personas.
Entre los trabajos presentados durante el encuentro científico se destacan dos metaanálisis, con las drogas dapagliflozina y empagliflozina. El primero de ellos incluyó un total de 11. 007 participantes, en tanto que el segundo comprendió a 9.718 individuos con insuficiencia cardíaca, independientemente de su función ventricular, es decir, de la capacidad de contracción del corazón. En ambos trabajos se observó que el uso de drogas como la dapaglifozina y la empaglifozina, ambas pertenecientes a una familia denominada 'glifozinas' -indicadas en el tratamiento de la diabetes tipo 2-, redujo la mortalidad cardiovascular y las hospitalizaciones por IC.
"Estas drogas mostraron un impacto muy significativo en la evolución de nuestros pacientes, independiente de la función ventricular, reduciendo la mortalidad, las hospitalizaciones por descompensación y mejorando la calidad de vida, algo muy deteriorado en personas con IC. Además, evidenciaron un efecto protector renal muy importante. Esto no es menor, si se tiene en cuenta que el deterioro de la función renal está relacionado con la generación de insuficiencia cardíaca y es un agravante de su evolución clínica", sostuvo el Dr. Alberto Fernández, médico cardiólogo especialista en Insuficiencia Cardíaca, que participará como coordinador en el Congreso SAC.22 en la mesa denominada 'Heart team en insuficiencia cardíaca. Aplicando el nuevo consenso SAC'.
La IC es una enfermedad en la que el corazón no puede bombear de manera eficiente la sangre para que llegue a todo el organismo y en consecuencia se acumula en los pulmones. De esta manera, no se obtiene el oxígeno necesario para el normal funcionamiento del organismo y la congestión en los pulmones provoca dificultad para respirar. La falla se puede presentar de manera abrupta (aguda) o establecerse en forma paulatina (crónica). Como consecuencia de la IC, como el corazón es incapaz de recibir la sangre que llega desde la periferia y los pulmones, pueden aparecer hinchazón, edemas, congestión y falta de aire (disnea).
Según el Dr. Fernández, estas drogas además mejoraron el control metabólico, ya que alguna de ellas demostró reducir la aparición de diabetes tipo II. "Todos los resultados se vieron tanto en los pacientes con diabetes como sin diabetes. Un dato para resaltar, es que en los individuos con insuficiencia cardíaca con función sistólica reducida (ICFSR), las glifozinas son complementarias al tratamiento con beta bloqueantes, antagonistas de los mineralcorticoides y ARNI (o IECA/AR II), un grupo de medicaciones que junto a ellas constituyen la 'cuádruple terapia', cuya indicación es de rigor en estos pacientes", aseveró.
En tanto, el Dr. Enrique Fairman, médico cardiólogo que integrará la misma mesa de trabajo del Dr. Fernández durante el congreso, afirmó que los progresos en el tratamiento de la insuficiencia cardíaca han sido extraordinarios en los últimos años y que hasta el advenimiento de las gliflozinas, el tratamiento establecido era con los betabloqueantes (bisoprolol, carvedilol y metoprolol) los antialdosterónicos (espironolactona y eplerenone) y el sacubitril valsartán.
"Con estos tratamientos se había logrado una reducción significativa de la mortalidad en los pacientes con insuficiencia cardíaca con la función ventricular deteriorada. Pero con las gliflozinas (empagliflozina y dapagliflozina) sumadas al arsenal terapéutico con el que contábamos, para este tipo de pacientes se ha logrado una reducción del 60% en la mortalidad cardiovascular, lo que significa, por ejemplo, en un sujeto de 55 años, una prolongación de la sobrevida de 5,5 años", subrayó el Dr. Fairman.
Por su parte, la Dra. Mirta Diez, médica cardióloga que participará, entre otras, en una mesa denominada 'Toma de decisiones en insuficiencia cardíaca avanzada', sostuvo que el otro aporte significativo de las gliflozinas es el beneficio en el grupo de pacientes con insuficiencia cardíaca con fracción de eyección preservada, una condición que representa un síndrome clínico complejo caracterizado por alteraciones cardíacas estructurales específicas y funcionales sobre el ventrículo izquierdo.
"Estas personas representan la mitad de los pacientes con insuficiencia cardíaca y hasta el momento no existía un tratamiento que hubiera demostrado reducción en la hospitalización y en la mortalidad cardiovascular", señaló.
La fracción de eyección es una forma de evaluar el funcionamiento del corazón. Como este órgano expulsa sangre hacia las arterias y recibe sangre de las venas, la cantidad de sangre que expulsa o eyecta en cada latido (que se llama "volumen latido" o "volumen sistólico") es una medida del funcionamiento cardíaco.
Dicha medida se obtiene mediante métodos de diagnóstico como, por ejemplo, la ecocardiografía. Se considera que la fracción de eyección se encuentra preservada (es decir, es normal) cuando su valor es mayor o igual a 50%. Si sus valores se hallan entre 49% y 41%, se considera fracción de eyección de rango medio, y si su valor es de 40% o inferior, está reducida. El deterioro de la fracción de eyección expresa una alteración en la capacidad de contracción del corazón y es una de las principales causas de la Insuficiencia Cardíaca.
"Estas drogas también demostraron su utilidad en los pacientes que están hospitalizados, por una descompensación del cuadro, es decir que el beneficio de las gliflozinas incluye a todos los pacientes con insuficiencia cardíaca", subrayó el Dr. Fairman.
Respecto de los efectos adversos reportados, entre los más importantes se destacan infecciones genitourinarias (minimizadas por una adecuada higiene), mucosas secas, taquicardia e hipotensión ortostática, que es una baja de presión que se produce al ponerse de pie después de estar sentado o acostado. Estos signos en gran medida se deben al efecto diurético y van decreciendo con el tiempo. Sin embargo, en líneas generales, no demostró diferencias sustanciales con respecto al placebo. El tratamiento debe indicarse con cuidado en los pacientes tratados con insulina, o en aquellos internados por situaciones graves de cualquier índole, donde es aconsejable su interrupción.
"A partir de los datos extrapolados de los estudios presentados, se ha consolidado la indicación de estos fármacos en todo el espectro de la Insuficiencia Cardiaca, tanto en las guías mundiales, como en la Argentina, presentada durante este Congreso.", concluyo el Dr. Fernández.
Cáncer de mama, el más común y principal causa de muerte en mujeres
Según la Organización Mundial de la Salud (OMS), el cáncer de mama es la principal causa de muerte en las mujeres y el tipo de cáncer más común, con más de 2,2 millones de casos en 2020. Además, estudios internacionales estiman que cerca de 1 mujer de cada 12 enfermarán de cáncer de mama a lo largo de su vida.
En Argentina los datos oficiales indican que anualmente se producen 6100 muertes por esta enfermedad y se registran más de 22.000 nuevos casos por año, lo cual representa el 32,1% del total de incidencia de cáncer en el país.
Por todos estos datos, es muy importante realizar tareas de prevención y utilizar la tecnología que hoy se brinda para poder hacer una detección precoz que terminará en una posible cura de la enfermedad.
¿Qué es el cáncer de mama?
“El cáncer de mama se origina cuando las células mamarias sufren cambios y comienzan a crecer sin control”, explica la Dra. Alejandra Belardo (Mn 78361), Médica Especialista en Ginecología, Jefa de Sección de Endocrinología Ginecológica del Servicio de Ginecología del Hospital Italiano de Buenos Aires.
“Las células cancerosas de la mama normalmente forman un tumor que a menudo se puede observar en un estudio de imágenes o se puede palpar como una masa o bulto. El cáncer de mamas ocurre casi exclusivamente en las mujeres, pero los hombres también lo pueden padecer”, agrega el Dr. Silvio Tatti (MN 54.387), Prof. Titular de Ginecología de la Facultad de Medicina de la UBA, Jefe del Servicio de Ginecología del Hospital de Clínicas Gral. José de San Martín.
“Es importante aclarar que la mayoría de los bultos en las mamas son benignos y no cancerosos o malignos. Los tumores benignos son crecimientos anormales, pero no se propagan fuera de las mamas. Cualquier bulto o cambio en la mama o cambios de coloración de la mama o textura, debe ser examinado por un profesional”, cuenta Belardo y recuerda por eso es tan importante el control anual o, en algunos casos, cada seis meses.
“La combinación de la detección precoz y las terapias eficaces, basadas en cirugía, radioterapia y farmacoterapia pueden generar excelentes resultados”, nos cuenta el Dr. Tatti.
“Otro tema a tener en cuenta es que el que un familiar de primer grado – madre, hermana o hija – padezca cáncer de mama casi duplica el riesgo de una mujer en tenerlo. El riesgo aumenta aproximadamente tres veces, si dos familiares de primer grado padecen la enfermedad”, aclara el Dr. Silvio Tatti.
¿Cuáles son los signos y síntomas más frecuentes del cáncer de mama?
- Detectar un bulto nuevo en la mama o la axila (debajo del brazo).
- Aumento del grosor o hinchazón de una parte de la mama.
- Irritación o hundimientos en la piel de la mama.
- Enrojecimiento o descamación en la zona del pezón o la mama.
- Hundimiento del pezón o dolor en esa zona.
- Secreción del pezón, que no sea leche, incluso de sangre.
- Cualquier cambio en el tamaño o la forma de la mama.
Hábitos saludables para prevenir el cáncer de mamas
Ambos médicos coinciden en algunas prácticas de la vida cotidiana que pueden llevarse a cabo para intentar realizar una prevención no solo del cáncer de mamas, sino además de un montón de otras patologías.
“Algunas prácticas saludables para prevenir el cáncer de mamas son el límite del consumo de alcohol. La recomendación general, según investigaciones sobre el efecto del alcohol en el riesgo de cáncer mamario, es limitarse a no más de una bebida al día, ya que incluso las cantidades pequeñas aumentan el riesgo”, explica el Dr. Silvio Tatti.
También agrega la necesidad de mantener un peso saludable. Se puede siempre acudir al médico o a un nutricionista para bajar de peso, reducir la cantidad de calorías que se consumen a diario es importante así como aumentar lentamente la cantidad de actividad física.
Belardo insiste con esto: “la actividad física puede ayudarte a mantener un peso saludable, lo que ayuda a prevenir el cáncer de mama. La mayoría de los adultos sanos deben tener como objetivo al menos 150 minutos a la semana de actividad aeróbica moderada o 75 minutos de actividad aeróbica vigorosa a la semana, más entrenamiento de fuerza al menos dos veces por semana”.
También recomiendan llevar una dieta saludable, que no solo puede prevenir el cáncer de mamas, sino también la diabetes, la enfermedad cardíaca y el accidente cerebrovascular. Por ejemplo, las mujeres que llevan una dieta mediterránea complementada con aceite de oliva extra virgen y frutos secos mixtos podrían tener un menor riesgo de sufrir cáncer de mama. La dieta mediterránea se centra principalmente en alimentos de origen vegetal, como frutas y verduras, cereales integrales, legumbres y frutos secos. Las personas que siguen la dieta mediterránea eligen grasas saludables, como aceite de oliva en lugar de manteca, y comen pescado en lugar de carne roja.
La importancia de la detección temprana
“El autoexamen mamario no presenta mayores dificultades y aquella mujer que decide hacerlo debe ser adecuadamente instruida por el profesional. En la mujer que aún menstrúa debe realizarse entre el día 7 y 10 del primer día de la última menstruación. En la paciente menopáusica se debe realizar una vez al mes, siempre el mismo día”, explica el Dr. Silvio Tatti, del Hospital de Clínicas.
“La mamografía y la ecografía mamaria son dos exámenes complementarios que ayudan a la detección precoz del cáncer de mama. La primera utiliza rayos X y la segunda usa ultrasonido para detectar cambios o alteraciones en la estructura de la mama y para detección de anormalidades como nódulos o calcificaciones”, explica la doctora Paulina Neira, radióloga de Clínica Las Condes.
“La ecografía mamaria se indica principalmente cuando la mujer presenta otros factores de riesgo como historia familiar de cáncer de mama o antecedentes de biopsias con diagnóstico de lesiones de alto riesgo y sobre todo en mamas densas, porque en estas pacientes la mamografía disminuye su rendimiento”, explica Tomás Piqueras, CEO de Centro de Servicios Hospitalarios. Y agrega que “este examen de ultra sonido permite diferenciar entre nódulos sólidos y nódulos con contenido líquido (quistes). Tiene también buen rendimiento a la hora de diferenciar entre condiciones benignas y malignas”.
Esto debe complementarse de acuerdo a la edad de la mujer con una mamografía. “La mamografía digital como método de screening está indicada a partir de los 40 o 50 años. Este estudio, a esta edad de la mujer, debe realizarse todos los años. A los 35 es conveniente realizar la primera y entre los 35 y los 50, una cada 2 años. Salvo que la paciente sea de riesgo. La mamografía es capaz de detectar cánceres de solo algunos milímetros, pero en ocasiones hay cánceres que no son detectables por mamografía, ya que si bien es un buen examen, su sensibilidad no supera el 80% e incluso puede ser menor en mujeres con mamas densas. En estos casos se ha demostrado la utilidad de complementar el estudio con ecografía mamaria”, indica el Dr. Silvio Tatti
Día Mundial de la Menopausia
El climaterio sucede cuando deja de ocurrir la menstruación y viene acompañado por una serie de cambios en el organismo producidos por la falta de estrógenos. El cuerpo sufre una serie de cambios asociados a la falta de hormonas que pueden producir alteraciones físicas y emocionales poco agradables. Hoy en día existen tratamientos de reemplazo hormonal que ayudan a disminuir estos síntomas tan molestos, sin ningún efecto colateral.
Algunas de estas alteraciones pueden llegar a provocar otras patologías secundarias debido a que el cambio hormonal en el cuerpo es muy grande y se pueden disparar algunos valores que antes estaban contenidos por la secreción hormonal, como es el caso de la hipertensión arterial, que en el 50% de las mujeres, se diagnostica durante el climaterio.
Durante las últimas décadas, la expectativa de vida de las mujeres se ha extendido considerablemente, pero la edad promedio del climaterio se mantiene en 44 años. Esto implica que cada vez más mujeres estén en una edad totalmente activa, tanto económica, social, sexualmente y cada vez más consultan con sus médicos sobre tratamientos que ayuden a reducir al mínimo los efectos de la menopausia.
Para estos síntomas poco agradables, existe una terapia de reemplazo hormonal, un tratamiento internacionalmente recomendado para tratar los síntomas como sofocos, sudoración excesiva y trastornos del sueño, así como también los producidos por atrofia en el tracto genital: sequedad vaginal y dispareunias.
Hace algunos años existían otros tratamientos que por el gran contenido de estrógenos se había demostrado que podían derivar en la generación de algún tipo de célula cancerígena, pero actualmente existen en el mercado tratamientos que ayudan a las mujeres a reducir los síntomas del climaterio a base de estradiol, el mismo estrógeno producido por los ovarios antes de la menopausia. Los estudios demuestran que estos tratamientos ayudan a reducir los efectos negativos a nivel físico y emocional del climaterio, sin generar otros daños colaterales, y sobre todo sin poner en riesgo la salud de la mujer.
Lo más visto
- Covishield, la vacuna que India lanzó con Oxford-AstraZeneca
- El gobierno establece los requisitos para la producción de cannabis medicinal
- Anmat aprobó en el país la primera vacuna que protege contra el dengue
- Comunicación de Novo Nordisk: Diferencias en la indicación de Victoza® y Saxenda®
- Ibupirac declarado apto para celíacos