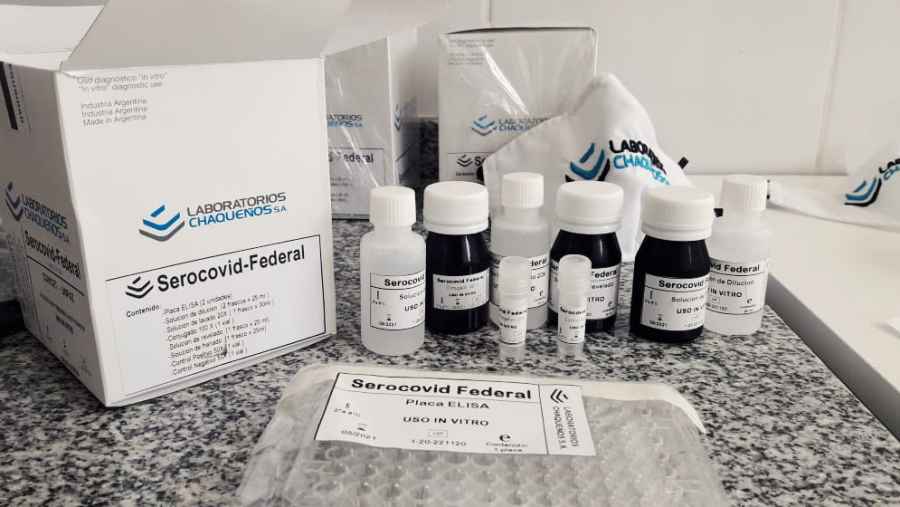
Serocovid-Federal: nuevo kit de producción local para detectar Covid-19
La Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) registró el kit Serocovid-Federal desarrollado por dos expertas del Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET) que detecta anticuerpos totales contra el SARS-CoV-2 y posee un 97 por ciento de eficacia. La producción se realizará en el laboratorio público Chaqueños S.A.
Se trata de un kit que utiliza la técnica Elisa que se llevó a cabo a través de un trabajo articulado entre la Universidad Nacional de José C. Paz (UNPAZ) donde se dio lugar a la investigación y al desarrollo; el Instituto Nacional de Tecnología Agropecuaria (INTA) donde se continuó su desarrollo; el laboratorio público Chaqueños S.A, en el que realizó el escalado y la producción del mismo; la Facultad de Ciencias Exactas y Naturales de la Universidad de Buenos Aires (FCEN-UBA) proveedora de la proteína recombinante que contiene secuencias del dominio RBD de SPIKE de SARS-CoV-2 ; la Administración Nacional de Laboratorios e Institutos de Salud “Dr Carlos G. Malbrán” en donde se realizó el testeo, y el mencionado laboratorio Chaqueños S.A.
Tanto el Ministerio de Salud, a través de la Agencia Nacional de Laboratorios Públicos (ANLAP), como el Ministerio de Ciencia, Tecnología e Innovación, a través de la Agencia Nacional de Promoción de la Investigación, el Desarrollo Tecnológico y la Innovación (Agencia I+D+i), fueron trascendentales en el acompañamiento, promoción y vinculación estratégica entre los distintos actores, y en el financiamiento del proyecto.
“En el marco de la pandemia de COVID-19, el Estado argentino puso en marcha acciones destinadas a promover y apoyar una asociación estratégica entre el sector académico y el sector de producción pública de medicamentos a fin de disponer de un insumo clave para el combate del COVID-19. Es un avance en materia sanitaria y un paso adelante en la reconstrucción de la matriz productiva de nuestro país. Un proyecto público con mirada federal y perspectiva de género”, explicó la presidenta de la Agencia Nacional de Laboratorios Públicos, Ana Allemand.
Científicos franceses avanzan en una vacuna nasal universal
Luego de tantos ensayos fallidos para llegar a tiempo con una vacuna anti COVID-19, algo más demorados, en caso de avanzar, este proyecto sería un salto en la lucha para convertir la pandemia en una epidemia manejable.
El grupo de expertos del Instituto Nacional de Investigación para la Agricultura, la Alimentación y el Medio Ambiente de Francia (INRAE), que trabajo junto a sus pares de la Universidad de Tours, presentaron la patente de un nuevo tipo de vacuna candidata contra el coronavirus.
El proyecto de vacuna nebulizada, un logro francés luego de tantos retrasos, podría encontrar toda su utilidad dadas sus características originales. Es una vacuna basada en proteínas, pero no dirigida únicamente a la proteína Spike, que está sujeta a múltiples mutaciones. Este inyectable nasal suma otras proteínas mucho más estables, lo que confiere cualidades de vacuna universal, es decir poco sensible a mutaciones.
Con éxitos previos en las investigaciones en animales, la segunda característica de esta vacuna, es su administración por vía nasal, en forma de nanopartículas capaces de adherirse a la mucosa de la nariz al ser administrada sin aguja, potencialmente mediante un spray.
En su nota de prensa publicada, el Instituto Nacional de Investigaciones Agroalimentarias y Ambientales del país, explicó que se trataría de un desarrollo de proteínas virales, encapsuladas sobre una base de almidón y lípidos. Este embalaje facilita su almacenamiento y uso. Sujeto a su seguridad, de amplio espectro, sería de sencilla aplicación en niños, pero también en todos los países donde la cobertura de vacunación es baja, en especial porque se puede almacenar en un refrigerador simple.
El mismo comunicado detalla que “la vacuna candidata a proteína anti-SARS-CoV-2 se basa en la experiencia del equipo de BioMap en el diseño de vacunas mucosas”, cuyos equipos “ya han logrado desarrollar una vacuna candidata eficaz para proteger a los monos de la toxoplasmosis”.
Según los investigadores, el modelo en desarrollo "permitiría ser protectora independientemente de las mutaciones virales y de la cepa de coronavirus circulantes".
Además, en la presentación, los investigadores anticiparon que este spray nasal podría servir como una tercera dosis de vacuna, una dosis de refuerzo para fortalecer la inmunidad de ciertos pacientes.
El soporte industrial, a partir de los éxitos clínicos, ha trasladado el proyecto a la creación de la biotecnológica LoValTech. Para este emprendimiento, la nueva compañía recibirá un apoyo financiero estatal de casi dos millones y medio de euros, aunque deberá recurrir a otros fondos para completar los estudios preclínicos y producir los lotes clínicos.
Sabiendo que la realización de los ensayos de Fase I y II debería ascender a unos 35 millones de euros, la compañía estima que puede realizar estas etapas en solitario antes de buscar un socio farmacéutico para la Fase III, que debería costar diez veces más.
¿Cuándo podemos esperar un lanzamiento ? Los investigadores franceses, esperan comenzar la fase de producción a mediados de año para comenzar la fase clínica, etapa crucial de las pruebas en humanos. “Este paso, que permitiría saber si podemos generalizar su uso, podría tener lugar en la segunda mitad de 2022″. Por lo tanto, no se podría comercializar antes de 2023.
Alzheimer: los biomarcadores que prometen cambiar su futuro
Cada tres segundos una persona en el mundo es diagnosticada con demencia. Según la Organización Mundial de la Salud (OMS) existen 50 millones de personas que la padecen y entre el 60% y 70% de esos casos corresponden a Alzheimer, la forma más común de demencia.
Durante la quinta edición del evento virtual de Biogen, NS Neuroscience Innovation Latam 2021, el prestigioso neurólogo español Alberto Lleó se refirió en el panel Tendencias actuales y futuras en Biomarcadores de la enfermedad de Alzheimer al potencial de estas moléculas biológicas que se encuentran en la sangre, otros líquidos o tejidos del cuerpo, y cuya presencia es un signo de un proceso anormal, de una afección o de una enfermedad.
En su presentación, el doctor Alberto Lleó, director de la Unidad de Memoria del Servicio de Neurología del Hospital de la Santa Creu i Sant Pau ubicado en Barcelona, España, nombró los biomarcadores disponibles para detectar el Alzheimer. De acuerdo con la definición de el Instituto Nacional del Cáncer NIH estadounidense, un biomarcador o marcador biológico es una molécula biológica que se encuentra en la sangre, otros líquidos o tejidos del cuerpo, cuya presencia es un signo de un proceso normal o anormal, de una afección o de una enfermedad. Un marcador biológico se utiliza a veces para determinar la respuesta del cuerpo a un tratamiento para una enfermedad o afección. También se le llama biomarcador, marcador molecular y molécula distintiva.
Uno de los hallazgos más relevantes de los últimos años es que las medidas de líquido cefalorraquídeo han sido claves en los ensayos clínicos para la enfermedad de Alzheimer; este elemento fue clave en la interpretación del efecto del fármaco a nivel cerebral, explicó Lleó. Existen también otros biomarcadores que son y pueden de ser de utilidad en la enfermedad, por ejemplo el de neurofilamentos de cadena ligera, una proteína que al ser liberada en líquido cefalorraquídeo produce un daño axonal, neuronal, que se ve en cualquier tipo de trastorno con daño, precisó el neurólogo.
En relación a este tipo de herramientas diagnósticas, subrayó: Los marcadores core se encuentran ya disponibles en la rutina clínica y son claves para el diagnóstico precoz del Alzheimer; la proteína tau y neurofilamentos marcan procesos solapantes pero ciertamente distintos y existen nuevos marcadores como las proteínas sinápticas que pueden ser útiles pero todavía hay que determinar cuál es el contexto de su uso. Los marcadores de líquido cefalorraquídeo juegan un papel clave en las investigaciones”.
El foco en la innovación
Minutos antes de la presentación del experto, el anfitrión y presentador del simposio, Guillermo Andino, explicó que este evento en neurociencias es el más importante de la región en donde se muestran los últimos avances en Esclerosis Múltiple, Atrofia Muscular Espinal, enfermedad de Alzheimer, Esclerosis lateral amiotrófica, entre otras afecciones.
Maximiliano Gutierrez, Managing Director LATAM South de Biogen, destacó que este espacio está pensado para difundir lo más destacado de las investigaciones científicas en curso y futuro de la neurociencia, contaremos con expertos de nivel internacional. En este contexto, la enfermedad de Alzheimer es el tipo de demencia más común en el mundo, por ello son muy necesarios biomarcadores para detectarla de manera temprana.
Por su parte, Alejandro Bagliano, Director Médico de Biogen, amplió: este año, por primera vez el evento tiene un alcance regional. Líderes internacionales compartirán las últimas novedades científicas de la neurociencia, siempre con el foco puesto en la innovación.
El aliado tecnológico
¿Cuáles son los avances en los biomarcadores en sangre? De acuerdo al neurólogo Alberto Lleó, en los últimos cinco años hemos asistido a una explosión de los marcadores en sangre para la enfermedad de Alzheimer, fundamentalmente ligados a un avance tecnológico. Las tres categorías ATM de biomarcadores ya están disponibles en sangre, se utilizan en ensayos clínicos, una de ellas se ha aprobado para su uso en Estados Unidos y en Europa; y finalmente tau fosforilado en plasma es muy útil para la detección de la patología Alzheimer y será implementada en las rutinas clínicas de estudios en los próximos meses y años, concluyó.
Consultado por Guillermo Andino en relación a la ponencia del doctor Lleó, el doctor médico especialista en neurología y psiquiatría Ricardo Allegri, investigador del Conicet y jefe de Neurología Cognitiva, Neuropsicología y Neuropsiquiatría de Fleni en Buenos Aires, destacó en relación al diagnóstico del Alzheimer en la Argentina: el primer punto para el diagnóstico clínico es evaluar si el paciente tiene trastorno cognitivo o no, información que resulta de la entrevista y evaluación neurológica y cognitiva, en donde se ve el tipo de afección que tiene esa persona; para finalmente completar con laboratorio y neuroimágenes.
Ahora bien, para el diagnóstico puntual tenemos que acudir a la utilización de biomarcadores. En nuestro grupo se utilizan biomarcadores de neuroimágenes y en líquido cefalorraquídeo”, detalló.
Por su parte, el doctor brasileño Ricardo Nitrini, fundador de la Unidad de Neurología Cognitiva y Comportamiento del Hospital Das Clínica de San Pablo y editor jefe de la revista científic Demencia y Neuropsicología, advirtió: El diagnóstico del Alzheimer en Brasil depende de un cuadro que permite tener un panorama sólo de los síndromes. El diagnóstico específico y real de la enfermedad se debe hacer con biomarcadores, de imagen, de resonancia magnética, etc., son análisis de importancia. Es necesario utilizarlos en Latinoamérica, y por lo menos en Brasil estamos preparados para hacer este análisis en algunos centros especializados.
El doctor Francisco Lopera, médico especializado en neurología, profesor y director del grupo de neurociencias de la Universidad Antioquia en Medellín, Colombia, puntualizó: En Colombia podemos hacer el diagnóstico clínico de la enfermedad de Alzheimer basados en la histórica clínica, en la entrevista o examen neurológico y en la evaluación neuropsicológica. Nos ayudamos con imagen de resonancia magnética para confirmar y tener más seguridad en el diagnóstico clínico. No utilizamos biomarcadores en líquido cefalorraquídeo o en plasma, pero en investigación sí tenemos acceso a este tipo de herramientas.
Los síntomas
El Alzheimer se manifiesta con la pérdida progresiva de memoria y otras habilidades cognitivas que interfieren con la vida cotidiana. Si bien se desarrolla más en personas mayores de 65 años, puede también afectar a más jóvenes. Con el avance de la investigación científica, ahora se sabe que en América Latina se puede reducir un 56% el riesgo de demencias como Alzheimer si se controlan mejor 9 factores para su prevención. En los enfermos menores de 50 años, la enfermedad es agresiva y en la madurez, si hay buenos cuidados, el paciente puede durar muchos años más con vida. A partir de los 45 años, la enfermedad puede presentarse de forma temprana, lo que se conoce como Alzheimer familiar o genético.
Entre los 60 y 70 años se puede presentar como Alzheimer esporádico, con una prevalencia del 7%, y se presenta después de los 85 años en más del 40 por ciento de la población, este tipo se relaciona más con la edad. El nombre de este padecimiento se debe a Alois Alzheimer, quien fue un neurólogo alemán que en 1901 estableció los síntomas de la enfermedad y en 1906 publicó sus descubrimientos.
La quinta edición del importante evento de Biogen NS Neuroscience Innovation Latam 2021 incluyó también la exposición de la investigadora colombiana Sandra Paipilla Eje microbiota-intestino-cerebro, futuro y objetivo terapéutico; el análisis del doctor Sergio Baranzini desde los Estados Unidos sobre el Impacto de la microbiota en la esclerosis múltiple, y la participación en la sección de preguntas y respuestas del experto argentino Jorge Correale.
Durante el evento, el investigador argentino del CONICET, Alejandro Montaner, abordó la temática Terapéutica de la inmunología, la droga revolucionaria que se desarrolló para el tratamiento del dolor; el doctor en Ciencias de la Computación de la Universidad Nacional del Centro de la Provincia de Buenos Aires, José Fernández León Fellenz, participó en el panel: Discriminación de la memoria al borde del miedo: Correlaciones neuronales en la corteza prelímbica.
A modo de cierre, se presentó el especial “Mujeres en STEM”, Science, Technology, Engineering and Mathematics (ciencia, tecnología, ingeniería y matemáticas por sus siglas en inglés). Allí expusieron Mayana Zatz, científica brasileña; desde México Laura Palomares y María Noel Vaeza y María Ines Fariello desde Uruguay.
Durante la última jornada se discutieron tópicos fascinantes de las neurociencias, entre ellos, el seguimiento de pacientes con Atrofia Muscular Espinal (AME) en el tercer milenio: ¿cómo pueden las nuevas tecnologías ayudar a los médicos a tomar decisiones?; la relevancia del diagnóstico genético de Esclerosis Lateral Amiotrófica (ELA) en la era de nuevos tratamientos específicos, proyectos innovadores; la rehabilitación cognitiva y telemedicina en la detección de rutina para fortalecer la memoria y la integración científica regional con los responsables políticos: Innovación 2030; Políticas Públicas – El Futuro de la Innovación y la Integración Regional.
NS Innovation Latam 2021 es el evento en neurociencias más importante de la región con los últimos avances en Esclerosis Múltiple, Atrofia Muscular Espinal, enfermedad de Alzheimer, Esclerosis lateral amiotrófica.
Anmat autorizaría los test de autodiagnóstico de Covid-19
En línea con lo que había anticipado ayer, la ministra de Salud, Carla Vizzotti, confirmó este mediodía en conferencia de prensa que la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (Anmat) se encuentra en la etapa final del análisis de la documentación para autorizar el registro.
“Estamos trabajando el tema del autotest y hay consenso de uso entre los ministros de Salud de las jurisdicciones”, adelantó la titular de la cartera sanitaria, quien destacó que el rol de estos test de autodiagnóstico de COVID-19 “va desde lo individual, en el autocuidado y el control de contactos estrechos y también son de utilidad para el sector privado en la prevención de brotes y demás estrategias para que se sostengan lo más posible las actividades económicas”.
Y tras destacar que en todo el mundo, con la alta transmisibilidad pero baja complejidad que presenta la variante Ómicron “no es tanto el colapso del sistema de salud sino que haya un impacto económico por los aislamientos”, Vizzotti sostuvo que “el rol que tiene el autodiagnóstico es tanto en el área educativa, como en el turismo y el sector privado en general generar la posibilidad del autodiagnóstico para que si alguien es positivo aunque sea asintomático evitar que vaya a su lugar de trabajo y genere un brote que cause aislamientos”.
“La Anmat está evaluando tres presentaciones de tres laboratorios y estamos en la etapa final de trabajo con las jurisdicciones para definir su uso”, amplió la ministra, para quien “sin lugar a dudas Argentina está capacitada para utilizarlos”.
Consultado al respecto, el médico infectólogo Ricardo Teijeiro consideró que “ante la demanda que supera la capacidad para realizar diagnóstico y considerando que en los países que fueron usados son exitosos, es una buena solución”. “Se puede usar en contactos estrechos que inicien con síntomas o asintomáticos al quinto día y en sintomáticos con autotest negativo se sugiere confirmar con PCR”, detalló.
En cuanto a la precisión de los test hogareños y la posibilidad de falsos negativos, el especialista del Hospital Pirovano y expresidente de la Sociedad Argentina de Infectología (Sadi) agregó: “Todavía no fue aprobado por Anmat, cuando lo apruebe tendremos las especificaciones”.
Consultada acerca de qué utilidad tendrá la aprobación de este producto en el país, en el marco de la subida exponencial de casos en el ingreso a la tercera ola de la pandemia en la Argentina, la presidente de la Confederación Farmacéutica Argentina (Cofa), María Isabel Reinoso consideró que “el mayor provecho será para testear a personas que tal vez tuvieron un contacto estrecho con un caso positivo y por no tener síntomas no se testean y no se aíslan”.
“Cuando el índice de positividad está por encima del 10% como hace varios días, eso indica que no se están detectando los casos de manera suficiente -apuntó Reinoso-. Además de acelerar la vacunación todo lo que se pueda, testear para aislar a tiempo a las personas infectadas es lo más efectivo para controlar la circulación viral y creo que hay que brindar herramientas para que la gente pueda hacerlo de manera sencilla”.
FDA aprueba el uso de emergencia de la pastilla anticovid-19 de Pfizer
La Administración de Alimentos y Fármacos (FDA, en inglés) de Estados Unidos ha autorizado este miércoles el uso de emergencia de Paxlovid, la pastilla de la farmacéutica Pfizer contra el Covid-19, el primer tratamiento oral contra esa enfermedad.
La FDA, el ente regulador de medicamentos en EEUU, anunció su decisión en un comunicado y especificó que la pastilla puede usarse para tratar casos moderados de Covid-19 en adultos y menores de 12 años que pesen al menos 40 kilogramos, alrededor de 88 libras, que tengan un alto riesgo de progresión a Covid-19 grave.
Los datos del ensayo clínico de Pfizer mostraron que su este antiviral tuvo un 90 por ciento de efectividad para prevenir hospitalizaciones y muertes en pacientes con alto riesgo de enfermedad grave. Además, los datos más recientes del laboratorio sugieren que el fármaco conserva su eficacia contra la variante ómicron.
Más de 120 millones de pastillas anticovid en 2022
Esta autorización proporciona una nueva herramienta para combatir el Covid-19 en un momento crucial de la pandemia, a medida que surgen nuevas variantes y promete hacer que el tratamiento antiviral sea más accesible para los pacientes con alto riesgo de progresión a Covid-19 grave“, ha señalado Patrizia Cavazzoni, directora del Centro de Evaluación e Investigación de Medicamentos de la FDA, en un comunicado.
El medicamento está disponible únicamente con receta y debe administrarse lo antes posible después del diagnóstico de Covid-19, dentro de los cinco días posteriores al inicio de los síntomas, según ha apuntado la FDA. Además, la compañía señaló que estaba lista para comenzar la entrega inmediata en el país y elevó sus proyecciones de producción a 120 millones de tratamientos de 80 millones en 2022.
En Europa la Agencia Europea de Medicamentos (EMA) respaldó su posible uso en un contexto de emergencia el pasado 17 de diciembre, bajo decisión individual de las autoridades nacionales a la espera de una licencia oficial europea.
The Lancet publica importantes resultados de la fase III de Convidecia™
CanSino Biologics Inc. ("CanSinoBIO") (SSE: 688185, HKEX: 06185) anuncia que en el día de la fecha, la revista The Lancet ha publicado los resultados de Fase III de su ensayo clínico sobre la seguridad y eficacia de su Vacuna Recombinante Novel Coronavirus (vector de adenovirus tipo 5) ("Ad5-nCoV", marca registrada: Convidecia ™). La publicación del análisis mostró que una dosis única de Convidecia™ tiene una eficacia del 96.0 % en la prevención de la enfermedad COVID-19 en su forma grave 14 días después de la vacunación, para la población de 18 años o más, sin que se hayan informado eventos adversos graves relacionados con la vacuna.
"Estamos muy felices de que los resultados de nuestro ensayo de Fase III sean completamente divulgados y publicados en The Lancet, una de las revistas médicas más prestigiosas del mundo. Esto representa un nuevo hito, y demuestra una vez más, la sólida protección que brinda nuestra vacuna monodosis, que ya se encuentra aprobada en 10 mercados, en distintos continentes. CanSinoBIO sigue comprometido en su misión de brindar protección inmunológica masiva, oportuna y accesible a la población mundial, y seguirá colaborando con socios en los sectores público y privado para mejorar el acceso a las vacunas y hacer que más personas se beneficien de nuestros avances tecnológicos", afirmó Dr. Xuefeng YU, Chairman & Chief Executive Officer of CanSinoBIO.
Estudio multicéntrico global muestra el perfil de seguridad y eficacia de la Fase III
El ensayo clínico Fase III de CanSinoBIO es un estudio multicéntrico, aleatorio, doble ciego y controlado con placebo que se llevó adelante en Argentina, Chile, México, Pakistán y Rusia con la participación de 45,000 voluntarios de todo el mundo, lo que representa el mismo tamaño de muestra que el de otros fabricantes globales de vacunas líderes.
Los resultados del ensayo de Fase III cumplieron con todos los principales criterios de valoración de eficacia del estudio e indicaron una tasa de eficacia global del 63.7 % (95% CI 52.9-72.1) y una tasa de eficacia del 96.0 % (95% CI 70.5-99.5)contra la enfermedad grave 14 días después de recibir una única dosis de Convidecia™. La tasa de eficacia general 28 días después de la vacunación fue del 57.5 % (95% CI 39.7-70.0, p=0.0026), con una tasa de eficacia del 91.7 % (95% CI 36.1-99.0) contra la enfermedad grave. Los resultados cumplieron con los requisitos de tasa de eficacia de la Organización Mundial de la Salud para las vacunas COVID-19. Además, el ensayo demostró la seguridad de Convidecia™ para un amplio rango etario de mayores de 18 años, incluidos los mayores de 60 años.
Actualizaciones recientes de estudios sobre dosis de refuerzo y vacunas inhaladas
Además de acortar significativamente el ciclo de vacunación, Convidecia™ se puede transportar y almacenar de manera estable entre 2°C y 8 °C, lo que la hace más accesible para regiones con instalaciones de almacenamiento insuficientes y bajos recursos médicos, reduciendo la carga que pesa sobre los sistemas de salud y los trabajadores médicos, y contribuyendo a la construcción de una amplia protección inmunológica a nivel global al aprovechar las ventajas de su régimen de dosis única.
CanSinoBIO también ha encontrado datos alentadores en el ensayo de dosis de refuerzo de Convidecia™ para personas inoculadas con dos dosis de vacunas inactivadas. Los datos mostraron que la administración de una dosis de refuerzo de Convidecia™ podría resultar en un aumento de aproximadamente 78 veces en los niveles de anticuerpos neutralizantes 14 días después de la vacunación. Mientras que la aplicación de una dosis de refuerzo homóloga de Convidecia™ seis meses después de la primera inmunización, podría resultar en un aumento de 7 veces en los niveles de dichos anticuerpos.
Por otro lado, CanSinoBIO ha logrado un progreso notable en el desarrollo de su Vacuna Recombinante COVID-19 (vector de adenovirus tipo 5) para inhalación. Los estudios demostraron que una combinación de la formas intramuscular e inhalada de Convidecia™ brinda una protección más fuerte que una sola dosis intramuscular. Los niveles de anticuerpos neutralizantes 28 días después del régimen mixto fueron cuatro veces más altos que los de una sola inyección intramuscular, que podría permanecer en un nivel alto después de 6 meses.
La versión inhalada de la vacuna de CanSinoBIO de COVID-19, Convidecia™ puede ser administrada por las vías respiratorias y pulmones, y así estimular la inmunidad de la mucosa y la inmunidad humoral, con una capa más de protección. CanSinoBIO está comprometido a seguir explorando la mejor estrategia de vacunación COVID-19 en todo el mundo, haciendo contribuciones continuas en la lucha mundial contra la pandemia.
La FDA podría autorizar las píldoras de Pfizer y Merck contra el Covid-19
La Administración de Alimentos y Medicamentos (FDA) de EEUU podría autorizar esta semana los tratamientos de las píldoras de Merck y Pfizer contra el COVID, según fuentes reportadas por Bloomberg.
El portal informó que ambas terapias recibirían la luz verde en los próximos días o incluso este miércoles, de acuerdo con tres fuentes no identificadas.
Ambos tratamientos (Paxlovid de Pfizer y Molnupiravir de Merck) apuntan a pacientes de alto riesgo que han dado positivo por COVID. Al ser administradas a domicilio y lograr una reducción sustancial de la gravedad de los cuadros, tienen el potencial de aliviar fuertemente la carga de los hospitales, muchos de los cuales están cerca de la saturación por la variante Ómicron en un momento complicado por el descenso de las temperaturas y las reuniones de fin de año.
En un ensayo clínico, el tratamiento de Pfizer mostró una reducción del 89% en las hospitalizaciones de los pacientes que recibieron el medicamento en los tres días siguientes a la aparición de los síntomas, en comparación con los pacientes que recibieron un placebo. Ninguno de los tratados con el fármaco murió, en el estudio con más de mil voluntarios, todos pacientes con comorbilidades.
Por su parte, los resultados clínicos publicados por Merck fueron decepcionantes ya que mostraban menos eficacia que en anteriores ensayos (a partir de resultados provisionales). Además, la compañía no recomienda su uso a mujeres embarazadas luego de que estudios con animales despertaran preocupaciones sobre su efecto en los fetos.
Los tratamientos con pastillas “son lo más importante que ha ocurrido en la pandemia después de las vacunas”, dijo Eric Topol, director del Instituto de Investigación
Traslacional Scripps, reportó Bloomberg.
El gobierno de Joe Biden ha solicitado por adelanto 10 millones de la píldora de Pfizer y otros tres millones a Merck.
La semana pasada, la Agencia Europa de Medicamentos permitió el uso en caso de urgencia de la píldora contra el covid de Pfizer en la UE, aunque todavía no está aprobada formalmente su introducción en el mercado. La píldora de Merck fue aprobada en el Reino Unido en noviembre, pero la UE no planea aprobarla hasta después de Navidad, según adelantó Reuters.
Droga para el cáncer de próstata reduce significativamente el riesgo de muerte
Una nueva alternativa terapéutica para el tratamiento del cáncer de próstata llegó al mercado de medicinas disruptivas y puede mejorar la calidad de vida de los pacientes diagnosticados con esta enfermedad.
Por este tipo de cáncer, 1,4 millones de hombres fueron diagnosticados durante 2020, según la Agencia Internacional para la Investigación del Cáncer (IARC). En Argentina es el tumor más frecuente en hombres: produce más de 11 mil casos nuevos al año.
La darolutamida, la nueva droga lanzada recientemente, es un tratamiento de alta eficacia que retrasa el tiempo de la aparición de metástasis, prolonga la sobrevida, tiene un bajo índice de efectos adversos y reduce el riesgo de muerte en más del 30% de los casos.
Además, minimiza el riesgo de efectos adversos ocasionados por los otros tratamientos de su clase -tales como fatiga, riesgo de fracturas, caídas, molestias en la piel o intolerancia gástrica- y ofrece un perfil de seguridad favorable, lo cual es importante para estos pacientes, ya que generalmente son asintomáticos y llevan una vida activa.
¿En qué droga se basa el tratamiento?
La darolutamida es la droga que, por su estructura química, inhibe el crecimiento de las células del cáncer, bloqueando la actividad de las hormonas sexuales masculinas llamadas andrógenos, como la testosterona.
El bloqueo de estas hormonas impide que las células cancerígenas, que afectan la próstata, crezcan y se multipliquen.
El medicamento se administra vía oral y ya fue admitido en más de 50 países de todo el mundo. En Argentina, cuenta con la aprobación regulatoria para ser comercializada.
“A pesar de los avances recientes en los tratamientos del cáncer de próstata, sigue existiendo una necesidad insatisfecha de nuevas opciones terapéuticas. En Bayer, trabajamos desde hace tiempo en la búsqueda de terapias diferenciadas”, señala Héctor Miranda, Director Médico de la División Farmacéutica de Bayer Cono Sur, la compañía que lanzó la nueva droga.
Daniel Londero, Head de la División Farmacéutica de Bayer para la región Cono Sur, adelanta que en los próximos 10 años esperan lanzar numerosos productos que den solución en oncología, salud femenina, oftalmología y medicina cardiovascular.
“Su principal diferencia, en relación con otros productos del mercado, es que además de su alta eficacia tiene un excelente perfil de cumplimiento debido a bajas tasas de efectos adversos”, explica Miranda.
Y agrega: “Mejora la calidad de vida de los hombres que han sido diagnosticados con cáncer de próstata que no se ha extendido a otras partes del cuerpo (metástasis) y que ya no responde a ningún tratamiento médico ni quirúrgico que disminuya la testosterona (resistente a la castración)”.
Pfizer anuncia una potente eficacia de su medicamento para Covid-19
Pfizer anuncia un nuevo avance en la lucha contra la COVID-19. Sin embargo, antes de que se comercialice, es imprescindible que este nuevo medicamento tenga el visto bueno tanto de la Agencia Europea del Medicamento (EMA) como de la Administración de Medicamentos y Alimentos de los Estados Unidos (FDA). En el estudio realizado, Pfizer sostiene que ninguna de las personas que recibió el nuevo tratamiento murió, mientras que se registraron 12 muertes entre los que recibieron el tratamiento placebo.
El tratamiento, útil contra la variante Ómicron
La farmacéutica argumenta que la efectividad del nuevo medicamento contra la COVID-19 es de un 89% en la prevención de hospitalizaciones y muertes por coronavirus en pacientes con alto riesgo. Además, resultó ser efectivo contra la variante Ómicron, después de los resultados obtenidos en un estudio en el que participaron más de mil personas.
El director ejecutivo, Albert Bourla, argumentó el pasado mes de noviembre que los datos sugieren que este antiviral “tiene el potencial de salvar la vida de los pacientes, reducir la gravedad de las infecciones por COVID-19 y eliminar hasta nueve de cada diez hospitalizaciones”.
Además, Pfizer menciona la realización de un segundo estudio en adultos de riesgo estándar, en el que se pudo comprobar que la reducción era de un 70% con respecto al riesgo de hospitalizaciones y muertes por COVID-19. Con respecto al primer estudio, Pfizer asegura que se percibió una disminución sustancial de la carga viral en el quinto día.
Paxlovid, un tratamiento administrado por vía oral
Este nuevo medicamento, que se comercializará bajo el nombre de Paxlovid una vez que reciba el visto bueno de las agencias reguladoras, será recetado para pacientes con COVID-19. Este tratamiento, que se administra por vía oral, debe tomarse dos veces al día (cada doce horas) durante cinco días, junto con otro medicamento, ritonavir.
La autorización de las agencias reguladoras de este nuevo antiviral para su administración en pacientes con COVID-19 supondrá un gran paso en la lucha contra esta enfermedad, en un contexto en el que los contagios se han visto incrementados por la detección de la variante Ómicron y en el que los países trabajan para inocular la dosis de refuerzo a su población.
Llamado a la acción para avanzar en la educación farmacéutica
La Federación Farmacéutica Internacional (FIP) emitió un llamado a la acción global estableciendo 18 acciones urgentes de avance de la educación en farmacia y ciencias farmacéuticas para ayudar a prevenir el déficit de 18 millones de trabajadores de la salud para 2030 predicho por el Organización Mundial de la Salud.
“Solo podemos satisfacer las necesidades farmacéuticas y de salud de nuestras sociedades si se desarrolla y despliega una fuerza laboral farmacéutica flexible y adaptable para aplicar al máximo sus conocimientos, habilidades, actitudes, comportamientos y habilidades. A medida que nos acercamos a 2030, instamos a todas las partes interesadas a tomar acciones para promover la educación farmacéutica ahora si queremos tener alguna perspectiva de cumplir con los Objetivos de Desarrollo Sostenible (ODS) de las Naciones Unidas ”, dice la Dra. Catherine Duggan, directora ejecutiva de la FIP.
Entre estas acciones se encuentran:
Aumentar la capacidad para proporcionar una fuerza laboral farmacéutica competente;
Apoyar el desarrollo de carrera temprana y marcos especializados avanzados;
Asegurar la calidad de la fuerza laboral farmacéutica asegurando la calidad de la educación y formación farmacéuticas;
Proporcionar condiciones laborales favorables y equitativas para la fuerza laboral académica, apoyar la equidad de género y abordar las desigualdades en la educación de los estudiantes;
Apoyar la enmienda e implementación de las políticas farmacéuticas y de salud existentes en favor del reconocimiento profesional de los farmacéuticos y científicos farmacéuticos, promover la asignación de recursos para aumentar la capacidad académica y empoderar al personal académico para brindar defensa y desarrollo de políticas a nivel nacional y regional.
Mejorar la educación interdisciplinaria e interprofesional y la colaboración con las partes interesadas clave;
Apoyar el desarrollo de programas como el regreso a la práctica después de interrupciones en la carrera y cambios de sector; y
Generar inteligencia de educación farmacéutica para medir los resultados educativos e informar las inversiones.
La FIP se ha comprometido a apoyar el logro de los ODS mediante la implementación de los Objetivos de Desarrollo de la FIP en toda la profesión farmacéutica. La federación ya está trabajando en la transformación del sector educativo a través del programa UNITWIN de la FIP-UNESCO.
“La FIP se compromete a proporcionar a sus redes plataformas, experiencia, capacidad, recursos, orientación y estándares globales para promover la educación, la formación y la investigación farmacéuticas”, sostiene la Dra. Duggan.
Lo más visto
- Covishield, la vacuna que India lanzó con Oxford-AstraZeneca
- El gobierno establece los requisitos para la producción de cannabis medicinal
- Anmat aprobó en el país la primera vacuna que protege contra el dengue
- Comunicación de Novo Nordisk: Diferencias en la indicación de Victoza® y Saxenda®
- Ibupirac declarado apto para celíacos