Mostrando artículos por etiqueta: Anmat
ANMAT aprobó la vacuna de Takeda para el Dengue
La Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) aprobó la vacuna del laboratorio Takeda para la prevención del dengue causado por cualquiera de los cuatro serotipos existentes del virus, en personas a partir de los 4 años, con o sin antecedentes de dengue, sin la necesidad de la realización de análisis de sangre confirmatorio previo a su aplicación. El esquema completo incluye dos dosis que deben aplicarse separadas por un intervalo de 3 meses.
Con la aprobación de la vacuna comienza un proceso que incluye diferentes etapas hasta que esté disponible en la Argentina para su utilización. El laboratorio está trabajando para acortar los tiempos de producción y distribución, estimando que estará disponible en nuestro país para mediados de la primavera.
En el estudio clínico TIDES, que incluyó cerca de 20 mil participantes sanos de zonas endémicas, con un seguimiento de 4,5 años, la nueva vacuna demostró, con dos dosis, reducir un 84% las hospitalizaciones por dengue y un 61% el riesgo de dengue sintomático, con un muy excelente perfil de seguridad. El programa clínico completo estuvo compuesto por 19 estudios contando los que ya se han completado y los que siguen en curso y representa el relevamiento más grande jamás realizado por Takeda para un producto farmacéutico en sus dos siglos y medio de historia.
Esta vacuna se basa en virus vivos atenuados, desarrollada a partir del serotipo 2 del dengue, que proporciona la ‘columna vertebral’ genética para los cuatro serotipos y está diseñada para proteger contra cualquiera de estos. En cuanto al almacenamiento, requiere conservación en heladera a una temperatura de entre 2 y 8° centígrados.
ver nota relacionada: https://www.revistadosis.com.ar/noticias/prevenir-como-objetivo-202211041804.html
Retiro del mercado de productos de Laboratorio Laborit SRL
Por indicación de la ANMAT, la firma Laboratorio Laborit SRL ha iniciado el retiro del mercado de los productos rotulados como:
- POMADA DE ÓXIDO DE CINC COMPUESTA LABORIT – PASTA LASSAR FNA Ed. N° 6, envase por 50 g, lote 191087 – vencimiento 10/22: se trata de un producto indicado en la prevención y tratamiento de la dermatitis del área del pañal, en dermatitis agudas y crónicas, y en la prevención de irritaciones en otras zonas de roce con la ropa u otras zonas de la piel.
- AGUA OXIGENADA 10 VOLÚMENES LABORIT FNA VII, envase por 250 ml, lote 200726 – vencimiento 11/23
- AGUA OXIGENADA 10 VOLÚMENES LABORIT FNA VII, envase por 100 ml, lote 200648 – vencimiento 08/23: se trata de un producto antiséptico indicado en heridas superficiales de la piel y enjuagues bucales tras extracciones dentales.
- AGUA BLANCA DEL CODEX LABORIT, envase por 250 ml, lote 191037 – vencimiento 09/22: se trata de un producto de uso externo empleado como antiséptico, desinflamatorio y cicatrizante.
- VASELINA LIQUIDA MEDICINAL LABORIT FNA Ed. N° 6, envase por 250 ml, lote 210061 – vencimiento 06/23: se trata de un producto utilizado como laxante.
- AGUA DE D´ALIBOUR LABORIT FNA Ed. N° 6, envase por 250 ml, lote 200788 – vencimiento 12/22: se trata de un producto de uso externo empleado como antiséptico y astringente.
La medida fue tomada luego de que se detectaran incumplimientos críticos y mayores a la Normativa de Buenas Prácticas de Fabricación y Control.
La Administración Nacional se encuentra realizando el seguimiento del retiro del mercado.
Anmat aprobó la Sputnik V nacional producida por Richmond
Laboratorios Richmond, empresa farmacéutica regional con base en Argentina, recibió en la tarde de ayer la aprobación por parte de la ANMAT de la vacuna Sputnik V (Componente I y Componente II), cuyo proceso de
elaboración final se realiza en Argentina.
Esta aprobación permitirá concretar la producción y comercialización de la vacuna, facilitando así el inicio de los trámites de registro ante las autoridades de regulación sanitaria de otros países de la región latinoamericana.
De esta forma, finaliza una etapa de obtención de certificaciones regulatorias que culminará, en los próximos meses, con la inauguración de una nueva planta modelo de biotecnología para la elaboración de vacunas más modernas y con tecnología de avanzada, pionera en el país. Actualmente, esta planta se encuentra en construcción dentro del predio de la empresa en el Parque Industrial de Pilar y dispondrá de una capacidad de producción máxima anual
de 500 millones de vacunas para COVID y otras enfermedades.
Asimismo, se destaca la tarea profesional de excelencia llevada a cabo por ANMAT en plena pandemia del COVID 19, ejerciendo con profesionalidad sus capacidades de fiscalización y regulación, y estableciendo exigencias que mejoraron la concreción del proyecto de elaboración en el país de la vacuna Sputnik V (Componentes I y II).
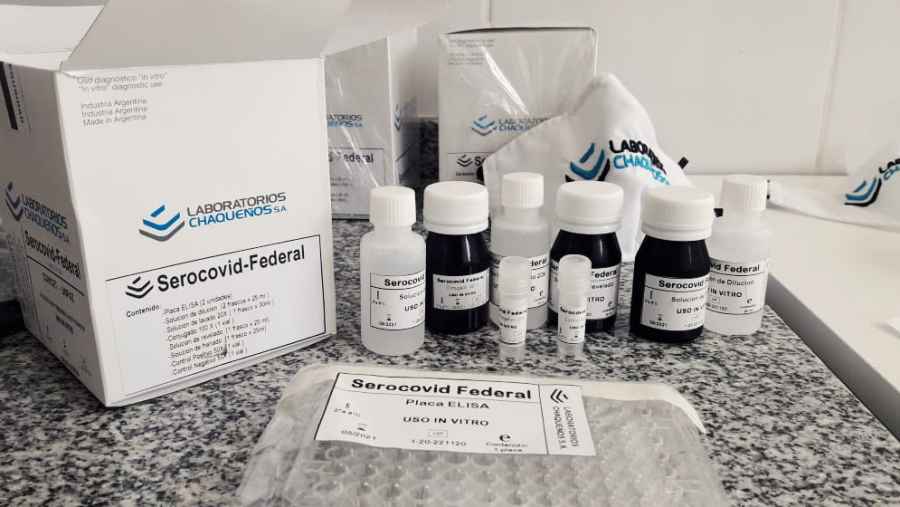
Serocovid-Federal: nuevo kit de producción local para detectar Covid-19
La Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) registró el kit Serocovid-Federal desarrollado por dos expertas del Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET) que detecta anticuerpos totales contra el SARS-CoV-2 y posee un 97 por ciento de eficacia. La producción se realizará en el laboratorio público Chaqueños S.A.
Se trata de un kit que utiliza la técnica Elisa que se llevó a cabo a través de un trabajo articulado entre la Universidad Nacional de José C. Paz (UNPAZ) donde se dio lugar a la investigación y al desarrollo; el Instituto Nacional de Tecnología Agropecuaria (INTA) donde se continuó su desarrollo; el laboratorio público Chaqueños S.A, en el que realizó el escalado y la producción del mismo; la Facultad de Ciencias Exactas y Naturales de la Universidad de Buenos Aires (FCEN-UBA) proveedora de la proteína recombinante que contiene secuencias del dominio RBD de SPIKE de SARS-CoV-2 ; la Administración Nacional de Laboratorios e Institutos de Salud “Dr Carlos G. Malbrán” en donde se realizó el testeo, y el mencionado laboratorio Chaqueños S.A.
Tanto el Ministerio de Salud, a través de la Agencia Nacional de Laboratorios Públicos (ANLAP), como el Ministerio de Ciencia, Tecnología e Innovación, a través de la Agencia Nacional de Promoción de la Investigación, el Desarrollo Tecnológico y la Innovación (Agencia I+D+i), fueron trascendentales en el acompañamiento, promoción y vinculación estratégica entre los distintos actores, y en el financiamiento del proyecto.
“En el marco de la pandemia de COVID-19, el Estado argentino puso en marcha acciones destinadas a promover y apoyar una asociación estratégica entre el sector académico y el sector de producción pública de medicamentos a fin de disponer de un insumo clave para el combate del COVID-19. Es un avance en materia sanitaria y un paso adelante en la reconstrucción de la matriz productiva de nuestro país. Un proyecto público con mirada federal y perspectiva de género”, explicó la presidenta de la Agencia Nacional de Laboratorios Públicos, Ana Allemand.
Anmat autorizaría los test de autodiagnóstico de Covid-19
En línea con lo que había anticipado ayer, la ministra de Salud, Carla Vizzotti, confirmó este mediodía en conferencia de prensa que la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (Anmat) se encuentra en la etapa final del análisis de la documentación para autorizar el registro.
“Estamos trabajando el tema del autotest y hay consenso de uso entre los ministros de Salud de las jurisdicciones”, adelantó la titular de la cartera sanitaria, quien destacó que el rol de estos test de autodiagnóstico de COVID-19 “va desde lo individual, en el autocuidado y el control de contactos estrechos y también son de utilidad para el sector privado en la prevención de brotes y demás estrategias para que se sostengan lo más posible las actividades económicas”.
Y tras destacar que en todo el mundo, con la alta transmisibilidad pero baja complejidad que presenta la variante Ómicron “no es tanto el colapso del sistema de salud sino que haya un impacto económico por los aislamientos”, Vizzotti sostuvo que “el rol que tiene el autodiagnóstico es tanto en el área educativa, como en el turismo y el sector privado en general generar la posibilidad del autodiagnóstico para que si alguien es positivo aunque sea asintomático evitar que vaya a su lugar de trabajo y genere un brote que cause aislamientos”.
“La Anmat está evaluando tres presentaciones de tres laboratorios y estamos en la etapa final de trabajo con las jurisdicciones para definir su uso”, amplió la ministra, para quien “sin lugar a dudas Argentina está capacitada para utilizarlos”.
Consultado al respecto, el médico infectólogo Ricardo Teijeiro consideró que “ante la demanda que supera la capacidad para realizar diagnóstico y considerando que en los países que fueron usados son exitosos, es una buena solución”. “Se puede usar en contactos estrechos que inicien con síntomas o asintomáticos al quinto día y en sintomáticos con autotest negativo se sugiere confirmar con PCR”, detalló.
En cuanto a la precisión de los test hogareños y la posibilidad de falsos negativos, el especialista del Hospital Pirovano y expresidente de la Sociedad Argentina de Infectología (Sadi) agregó: “Todavía no fue aprobado por Anmat, cuando lo apruebe tendremos las especificaciones”.
Consultada acerca de qué utilidad tendrá la aprobación de este producto en el país, en el marco de la subida exponencial de casos en el ingreso a la tercera ola de la pandemia en la Argentina, la presidente de la Confederación Farmacéutica Argentina (Cofa), María Isabel Reinoso consideró que “el mayor provecho será para testear a personas que tal vez tuvieron un contacto estrecho con un caso positivo y por no tener síntomas no se testean y no se aíslan”.
“Cuando el índice de positividad está por encima del 10% como hace varios días, eso indica que no se están detectando los casos de manera suficiente -apuntó Reinoso-. Además de acelerar la vacunación todo lo que se pueda, testear para aislar a tiempo a las personas infectadas es lo más efectivo para controlar la circulación viral y creo que hay que brindar herramientas para que la gente pueda hacerlo de manera sencilla”.
Anmat aprobó dos nuevos test para Covid-19
La UNSAM y la empresa nanobiotecnológica CHEMTEST siguen mostrando de modo ejemplar lo potentes que pueden resultar las articulaciones público-privadas. En esta ocasión la sinergia universidad-empresa permitió el desarrollo de dos nuevos productos que la semana pasada obtuvieron la aprobación de la ANMAT.
El producto más novedoso es un kit para la medición cuantitativa de anticuerpos para COVID19 en base al primer estándar internacional elaborado por la Organización Mundial de la Salud (OMS). Se llama Chemlis COVID-19 Quanti IgG y es el primero de su tipo en Argentina. No sólo informa si una persona tiene anticuerpos: también dilucida si los tiene en cantidad suficiente para estar protegida. En este sentido es ideal para esta etapa de la pandemia, ya que a partir de parámetros internacionales permite decidir si es necesario administrar dosis de refuerzo de las vacunas contra COVID19.
El otro producto es la versión 2.0 del test molecular para COVID19 aprobado en junio de 2020, ELA Chemstrip. La versión mejorada es más fácil y rápida de usar y tiene menor costo. Con estas incorporaciones, ya son cuatro los productos de la línea diagnóstica dedicada a COVID19. El segundo fue el test rápido de anticuerpos CHEMSTRIP COVID19 IgM / IgG Cardtest.
Investigadores de CHEMTEST y del IIB de la UNSAM
El equipo de investigación y desarrollo (I+D) detrás de estos dos nuevos productos estuvo compuesto por 12 científicxs, distribuidos en dos grupos: el del Instituto de Investigaciones Biotecnológicos (IIB) y el de CHEMTEST. Los líderes y articuladores de los dos grupos fueron los investigadores del IIB y directores de CHEMTEST Diego Comerci, Juan Ugalde y Andrés Ciocchini. Por parte del IIB participaron lxs investigadorxs Cecilia Czibener, Diego Rey Serantes, Soledad Guidolin y Julieta Roldán.
Es muy motivador trabajar en equipo para ofrecer una solución a la sociedad. La investigación científica en ciencia básica tiende a ser más individual y entre las satisfacciones más grandes está la de publicar un artículo en revistas como Science. Con la pandemia y el redireccionamiento de mi trabajo descubrí que estos desarrollos ofrecen otro tipo de motivación y satisfacciones: desde trabajar en equipo y sentir que lo que una hace forma parte de una rueda, a la satisfacción de ver el producto final, contó la investigadora del CONICET en el IIB, Cecilia Czibener.
Por Chemtest participaron Luciano Melli, Stella Maris Landivar, Agustina Carreño, Aldana Arias y Tamara Laube. Melli, Landivar y Carreño son egresados de la Licenciatura en Biotecnología de la UNSAM y Melli y Landivar hicieron además el Doctorado en Biología Molecular y Biotecnología, también en la UNSAM. La tesis doctoral de Melli fue elegida como la mejor del campo en 2017-2018 y la de Landivar está próxima a ser defendida.
En este proyecto participamos diferentes generaciones de doctores y doctoras en Biotecnología y Biología Molecular de la UNSAM: Juan, Diego, Andrés y Cecilia son de la primera generación, yo sería de la segunda y Stella Maris de la tercera. Compartimos el mismo proyecto de desarrollar biotecnología en Argentina, para atender las necesidades del país, aseguró Luciano Melli, quien se desempeña como investigador del CONICET en CHEMTEST y coordinó junto con Stella Maris Landivar el equipo de trabajo al que también aportaron Carreño, Aria y Laube.
Me sumé a CHEMTEST desde el principio, cuando era una start up incipiente y recorrimos los momentos más duros. Ver a la empresa consolidada y floreciendo es un sueño cumplido, compartió Melli.
Chemlis COVID-19 Quanti IgG
Es un test de laboratorio (se hace con placas Elisa de 96 pocillos) para la detección cualitativa y cuantitativa de anticuerpos anti-SARS-CoV2, a partir de una muestra de sangre (en la reacción se usa suero o plasma obtenido con EDTA, heparina o citrato de sodio).
Detecta todos los anticuerpos dirigidos contra la proteína Spike, con un 100% de sensibilidad y especificidad diagnóstica. Como además fue especialmente diseñado para la determinación en Unidades Internacionales/ml (UI/ml) utilizando como referencia el Primer Estándar Internacional WHO para la inmunoglobulina humana anti-SARS-CoV2 (Código NIBSC: 20/136), es ideal para hacer seguimiento y evaluación de la respuesta inmunológica post vacunación y post COVID19.
Es una herramienta central para determinar quién y cuándo necesita una tercera dosis de refuerzo, porque cuando caen los anticuerpos hay que volverlos a subir con un shot más de vacuna, explicó Diego Comerci, director de CHEMTEST.
Durante el desarrollo del producto se evaluó su desempeño diagnóstico en una población de vacunados con dos dosis de Sputnik V, con y sin infección previa. Como se muestra en la figura de más abajo, las muestras obtenidas de individuos vacunados con infección previa arrojaron valores de reactividad en promedio muy superiores a los obtenidos con las muestras de individuos solo vacunados. Este tipo de información es útil por ejemplo determinar que quienes no estuvieron infectados tengan prioridad para dosis de refuerzo respecto de quienes superaron la infección por COVID19.
ELA Chemstrip 2.0
El kit ELA Chemstrip fue desarrollado por las empresas biotecnológicas CHEMTEST y PB-L en conjunto con la UNSAM y la UNQ. Es un test de diagnóstico molecular (PCR) por amplificación isotérmica, que desde su presentación en junio de 2020 se utilizó en más de 600 mil determinaciones en todo el país. La semana pasada la ANMAT aprobó la versión 2.0 de ese kit, que trae mejoras que lo hacen más fácil, rápido y económico de utilizar. A diferencia de la versión original, la 2.0 trae una solución para inactivar el virus presente en las muestras: hay que poner unas gotitas en el tubo con el hisopo y agitar. Cinco minutos después esa muestra se puede manipular sin peligro de contagio. “El protocolo indica que si no se inactiva la muestra, el testeo tiene que realizarse dentro de una campana de extracción, que es costosa y requiere habilitaciones. Eso va en contra del sentido con el que hacemos nuestros kits, que es permitir la descentralización de los testeos y su ejecución en lugares con poca infraestructura”, explicó Juan Ugalde, director de CHEMTEST y decano del Instituto de Investigaciones Biotecnológicas de la UNSAM.
Otra ventaja de la versión 2.0 es que utiliza una sola tira reactiva, en lugar de dos. “El Kit ELA Chemstrip ofrece resultados tan confiables como una PCR, con menos equipamiento. Con estos cambios se requiere todavía menos equipamiento: lo más complejo es un equipo (termobloque) para calentar las muestras a temperatura constante para multiplicar la presencia del virus y hacer más fácil su detección”, explicó Ugalde.
Aprueban en Argentina una nueva medicación para el asma grave
En Argentina, el asma afecta a más del 12% de los niños y adolescentes y a cerca del 6% de la población entre 20 y 44 años. Causa por año más de 400 muertes y 15 mil internaciones en hospitales públicos de todo el país.
Es que alrededor de un 20% de los pacientes presenta una variante moderada a severa de la enfermedad y no logra un buen control, lo que suele evidenciarse con síntomas persistentes y exacerbaciones recurrentes. Las exacerbaciones son episodios agudos y angustiantes, caracterizados por falta de aire, sensación de opresión en el pecho y tos, que pueden terminar en una internación. Los pacientes graves o severos son aquellos en los que el asma persiste pese a utilizar altas dosis de la terapia habitual (corticoides inhalados en dosis máximas, sumado a uno o más broncodilatadores de larga duración).
Para este grupo de pacientes con un asma de semejante intensidad, existe una nueva opción terapéutica disponible en nuestro país, ya que la ANMAT aprobó el uso de la droga dupilumab en adultos y adolescentes a partir de 12 años de edad.
Según la aprobación, sirve como tratamiento de mantenimiento complementario para el asma severa con inflamación de tipo 2 caracterizada por eosinófilos en sangre elevados y/o FeNO elevado, que no se controlan adecuadamente con dosis altas de corticosteroides inhalados, más otro medicamento para tratamiento de mantenimiento. Dupilumab es un anticuerpo monoclonal de origen completamente humano que ha demostrado su capacidad de reducir significativamente las exacerbaciones por asma, mejorar la función pulmonar y la calidad de vida de los pacientes.
“Esta nueva medicación está indicada para los pacientes con asma grave, que presentan una historia de exacerbaciones, hospitalizaciones de urgencia y una función pulmonar disminuida, que usan demasiados corticoides por vía oral o inyectable y tienen una pésima calidad de vida. Su asma les impide o dificulta hacer ejercicio, caminar rápido, subir escaleras o dormir de corrido. Contamos con un tratamiento muy esperanzador, lo que representa una excelente noticia para estos pacientes y sus médicos”, sostuvo el doctor Daniel Colodenco, médico neumonólogo, Director de la Carrera de Especialistas en Neumonología de la UBA y ex Jefe de Alergia e Inmunología del Hospital ‘María Ferrer’.
“Los casos graves no son necesariamente infrecuentes, sino que, en ocasiones, algunos pacientes tienden a subestimar la severidad de la enfermedad o tal vez sea resignación: luego de años de convivir con determinados síntomas, los incorporaron como parte de su vida, pero no hay por qué conformarse con una vida limitada por el asma”, agregó la doctora Ana María Stok, neumonóloga, Directora Médica de Investigaciones en Patologías Respiratorias y Coordinadora General del Grupo Asma NOA.
Respecto de los objetivos terapéuticos en el asma grave, Stok describió que “ningún paciente es igual a otro, pero para estos cuadros graves, por lo general, se busca reducir los episodios de exacerbaciones severas, que preocupan mucho a los pacientes. Otro objetivo es mejorar la función pulmonar para recuperar calidad de vida: no tener que ausentarse a la escuela o al trabajo, ni dejar que tu asma te aísle de todo. Además, para quienes usan corticoides orales, tanto en forma diaria como en ciclos cortos, procuramos ir reduciendo de a poco su uso y, si es posible, hacerlo por completo”.
“Este último punto es particularmente relevante porque sabemos que más de dos cursos anuales de corticoides aumentan la posibilidad de contraer o agravar cuadros como diabetes, síndrome metabólico, osteoporosis, hipertensión arterial, obesidad, depresión y cataratas, entre otras afecciones”, completó Colodenco.
Mejor control del asma grave con dupilumab
En el estudio clínico LIBERTY ASTHMA QUEST, que incluyó 1902 pacientes mayores de 12 años, el uso de dupilumab redujo un 47,7% más que el placebo la tasa anual de exacerbaciones severas y mejoró al doble la función pulmonar, promoviendo un mejor control del asma.
Respecto del uso de corticoides orales, en el estudio VENTURE, que incluyó 210 pacientes, el 70.1% de quienes recibieron dupilumab logró reducir su dosis (contra 41.9% en el grupo control). El 80% de los que recibieron la droga y redujeron la dosis de corticoides, lo hizo al menos a la mitad (contra un 50%); el 69% del primer grupo pudo llevarla a menos de 5 mg/día (contra 33%) y el 48% pudo dejar los corticoides orales por completo (contra el 25% en el otro grupo). En total, la tasa de exacerbaciones severas fue un 59% menor en quienes recibieron dupilumab y mejoraron más la función pulmonar.
Además, el estudio abierto de extensión denominado TRAVERSE siguió a largo plazo a los participantes de los dos estudios antes mencionados y mostró que todos los resultados se sostuvieron en el tiempo durante 96 semanas más luego de finalizadas esas investigaciones. Entre el 50% y el 70% de los casos de asma se originan por una respuesta hiperactiva de un mecanismo inflamatorio denominado ‘inflamación de tipo 2’ lo que aumenta la secreción mucosa, obstruye las vías aéreas y genera hiperreactividad bronquial, procesos que generan las manifestaciones que afectan la vida cotidiana del paciente.
Gran parte de este mecanismo se explica por un aumento de la actividad de proteínas conocidas como interleuquinas 4 y 13, que son responsables de la limitación que la enfermedad severa les impone a los pacientes. Stok puntualizó que “los estudios clínicos incluyeron pacientes con asma grave en general, pero los resultados de eficacia fueron consistentemente superiores en los pacientes en los que se podía identificar la presencia de biomarcadores asociados con inflamación de tipo 2”.
“Este mismo proceso inflamatorio se da en otras enfermedades como la dermatitis atópica, la poliposis nasal y determinadas alergias alimentarias. De hecho, es habitual que una persona con asma presente simultáneamente alguna de esas comorbilidades. La primera aprobación que obtuvo dupilumab en nuestro país fue en 2020, en dermatitis atópica severa, y está siendo investigado para otros cuadros mediados por mecanismos inmunológicos afines”, concluyó Colodenco.
ANMAT aprobó la venta en farmacias de un test rápido de Covid-19
La Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) autorizó la venta en farmacias de un test rápido de coronavirus.
El producto en cuestión es de origen chino, se conoce como Immunobio, y su desarrollo estuvo en manos del laboratorio Hangzhou Immuno Biotech CO Ltd. Es importante mencionar que se trata del único autorizado por la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) para su venta en farmacias.
El test rápido de coronavirus permite conocer el resultado en aproximadamente 10 minutos. Ese resultado tiene una efectividad del 96,8%. De todas maneras, es muy importante estar atentos a la advertencia que el propio envase brinda.
Allí se aclara que en caso de dar negativo esto no descarta una posible presencia del virus en la persona testeada. “Los resultados negativos no descartan infección por Covid-19”, dice.
Es importante tener en cuenta que el test rápido no es para que las personas vayan por su cuenta, lo compren y lo hagan en sus casas. Se trata de una prueba que, si bien está autorizada a venderse en farmacias, es de uso profesional exclusivo. Esto significa que debe ser un profesional de la salud quien realice el test a la persona que crea tener coronavirus o que necesite saber su estado de salud.
Se trata de un test de antígeno que se hace a través de un hisopado “para la detección cualitativa de antígenos del nuevo coronavirus SARS-CoV2 utilizando secreciones de garganta humana y secreciones nasales. El mismo está compuesto por una bolsa de aluminio con cassete de prueba y desecante, tampón de ensayo (buffer), hisopo estéril y tubo de recolección de muestras e instrucciones de uso”.
Nuevo tratamiento para el HIV aprobado por ANMAT
La idea surgió en Argentina y fue llevada a cabo con el apoyo de ViiV-GSK. Se trata de un esquema de tratamiento simplificado e innovador con menor toxicidad que brinda una mejor calidad de vida a las personas que viven con VIH (PVVIH).
Esta nueva opción de tratamiento, que ahora está disponible en Argentina, es el resultado de un estudio clínico iniciado en nuestro país y que fue ratificado por los estudios GEMINI. La Fundación Huésped, Helios, el Hospital Italiano de Buenos Aires, el Hospital Municipal Vicente López “Dr. Houssay” y el Instituto CAICI fueron algunas de las instituciones en las que se llevó a cabo el estudio en nuestro país.
El estudio GEMINI contó con la participación de más de 1400 personas con VIH que no habían sido previamente tratadas de Europa, las Américas, África y la región del Asia-Pacífico, y se realizó a partir de los precedentes expuestos en el Estudio PADDLE, un proyecto piloto realizado íntegramente en Argentina por el equipo de investigadores de Fundación Huésped. Asimismo, el PADDLE continuó la línea del estudio GARDEL (diseñado, organizado y dirigido por Fundación Huésped), que demostró que la bi-terapia con esquemas con lamivudina eran igual de efectivos que los de triple terapia. Sobre la base de los resultados del Estudio PADDLE, el laboratorio ViiV diseñó el GEMINI, un estudio multi-céntrico internacional que probó esta estrategia a gran escala.
Este nuevo esquema de tratamiento deja en evidencia el enorme potencial que tiene la Argentina en investigación científica clínica. Personas que viven con HIV en nuestro país van a poder acceder a un tratamiento menos tóxico e igual de eficaz que los que ya estaban disponibles, lo que va a tener un impacto positivo en su vida a largo plazo, comentó Rosana Felice, Directora Médica de GSK Argentina & Cono Sur.
Durante los últimos 15 o 20 años el estándar de tratamiento del VIH giraba alrededor de un esquema de tres drogas. Ahora que tenemos drogas más potentes el enfoque está orientado a mejorar la tolerabilidad y la conveniencia. El estudio GEMINI demostró que podemos obtener la eficacia del uso de tres drogas en un régimen de dos con la tolerabilidad e interacción de un esquema de 3 drogas, comentó Pedro Cahn, Investigador Principal del estudio y Director Científico de la Fundación Huésped.
La FDA (Administración de alimentos y medicamentos de EEUU), la Agencia Europea de Medicamentos (EMA) y ahora la ANMAT dieron su aprobación a este esquema de tratamiento. Esta combinación de antirretrovirales posee dos drogas que actúan en puntos diferentes de la replicación del VIH (integración y transcripción inversa) logran evitar que el VIH se multiplique.
ANMAT actualizó los lotes de vacunas antigripales liberados
Listado de los lotes de vacunas antigripales liberados al día 5 de abril de 2021.
| NOMBRE COMERCIAL | LABORATORIO | N° LOTE | |
|---|---|---|---|
| AFLURIA QUAD | LABORATORIOS SEQIRUS S.A. | 298762 | TETRAVALENTE |
| AFLURIA QUAD | LABORATORIOS SEQIRUS S.A. | 299447 | TETRAVALENTE |
| AFLURIA QUAD | LABORATORIOS SEQIRUS S.A. | 299448 | TETRAVALENTE |
| AFLURIA QUAD JR | LABORATORIOS SEQIRUS S.A. | 299450 | TETRAVALENTE |
| AGRIPPAL S1 | LABORATORIOS SEQIRUS S.A. | 014309 | TRIVALENTE |
| AGRIPPAL S1 | LABORATORIOS SEQIRUS S.A. | 014310 | TRIVALENTE |
| FLUXVIR | SINERGIUM BIOTECH S.A. | 014535 | TRIVALENTE |
| FLUXVIR | SINERGIUM BIOTECH S.A. | 014536 | TRIVALENTE |
| FLUXVIR | SINERGIUM BIOTECH S.A. | 014537 | TRIVALENTE |
| FLUXVIR | SINERGIUM BIOTECH S.A. | 014654 | TRIVALENTE |
| FLUXVIR | SINERGIUM BIOTECH S.A. | 014655 | TRIVALENTE |
| FLUXVIR | SINERGIUM BIOTECH S.A. | 014656 | TRIVALENTE |
| INFLUVAC TETRA | ABBOTT LABORATORIES ARGENTINA S.A. | Y08 | TETRAVALENTE |
| INFLUVAC TETRA | ABBOTT LABORATORIES ARGENTINA S.A. | Y10 | TETRAVALENTE |
| ISTIVAC 4 | SANOFI PASTEUR | V3A671V | TETRAVALENTE |
| ISTIVAC 4 | SANOFI PASTEUR | V3A672V | TETRAVALENTE |
| ISTIVAC 4 | SANOFI PASTEUR | V3A701V | TETRAVALENTE |
| ISTIVAC 4 | SANOFI PASTEUR | V3A702V | TETRAVALENTE |
| ISTIVAC 4 | SANOFI PASTEUR | V3A703V | TETRAVALENTE |
| ISTIVAC 4 | SANOFI PASTEUR | V3A704V | TETRAVALENTE |
| VIRAFLU | SINERGIUM BIOTECH S.A. | 014372 | TRIVALENTE |
| VIRAFLU | SINERGIUM BIOTECH S.A. | 014395 | TRIVALENTE |
| VIRAFLU | SINERGIUM BIOTECH S.A. | 014402 | TRIVALENTE |
| VIRAFLU | SINERGIUM BIOTECH S.A. | 014403 | TRIVALENTE |
| VIRAFLU | SINERGIUM BIOTECH S.A. | 014424 | TRIVALENTE |
| VIRAFLU | SINERGIUM BIOTECH S.A. | 014427 | TRIVALENTE |
| VIRAFLU | SINERGIUM BIOTECH S.A. | 014456 | TRIVALENTE |
| VIRAFLU | SINERGIUM BIOTECH S.A. | 014457 | TRIVALENTE |
| VIRAFLU | SINERGIUM BIOTECH S.A. | 014570 | TRIVALENTE |
| VIRAFLU | SINERGIUM BIOTECH S.A. | 014625 | TRIVALENTE |
| VIRAFLU | SINERGIUM BIOTECH S.A. | 014626 | TRIVALENTE |
| VIRAFLU | SINERGIUM BIOTECH S.A. | 014595 | TRIVALENTE |
| VIRAFLU PEDIÁTRICA | SINERGIUM BIOTECH S.A. | 014397 | TRIVALENTE |
| VIRAFLU PEDIÁTRICA | SINERGIUM BIOTECH S.A. | 014404 | TRIVALENTE |
| VIRAFLU PEDIÁTRICA | SINERGIUM BIOTECH S.A. | 014523 | TRIVALENTE |
Lo más visto
- Covishield, la vacuna que India lanzó con Oxford-AstraZeneca
- El gobierno establece los requisitos para la producción de cannabis medicinal
- Anmat aprobó en el país la primera vacuna que protege contra el dengue
- Comunicación de Novo Nordisk: Diferencias en la indicación de Victoza® y Saxenda®
- Ibupirac declarado apto para celíacos