Octubre: un mes para cuidar la salud visual
El 12 de octubre se celebra el Día Mundial de la Visión, una iniciativa de la Organización Mundial de la Salud (OMS) y de la Agencia Internacional para la Prevención de la Ceguera (IAPB, por sus siglas en inglés) para generar conciencia social sobre la importancia de la consulta oftalmológica a tiempo. Este tipo de consultas podría evitar el 80% de las discapacidades visuales.
Según los últimos datos proporcionados por la IAPB en el mundo hay 36 millones de personas ciegas y 217 millones de personas viven con discapacidad visual severa a moderada. En total, 253 millones de personas vivían en 2015 con deficiencia visual. También se estima que 1,1 mil millones de personas tienen deficiencia de visión de cerca, una condición que puede corregirse con lentes.
Mantener una buena salud visual no cuesta tanto. Basta con realizar un examen oftalmológico, al menos una vez al año, para detectar no solo los problemas de graduación que derivan en una visión defectuosa, sino también algunos problemas patológicos que pueden provocar consecuencias mucho más graves para la visión de las personas.
También es necesario protegerse de agentes cotidianos que provocan daños a la vista, como la contaminación ambiental, la mala iluminación, el deslumbramiento, la exposición prolongada a los rayos UV y a la luz azul nociva emitida por dispositivos digitales.
Estos factores, en la infancia, tienen aún mayores consecuencias. Se estima que el 80% de los daños causados por la exposición a la radiación UV ocurre antes de los 18 años, razón de sobra para tomar medidas de protección ocular también en los niños con el fin de reducir problemas visuales en la vida adulta.
Una medida apropiada de protección frente a estos factores nocivos para la vista es el uso diario de lentes con tecnología fotosensible, los cuales se adaptan automáticamente a cualquier cambio de iluminación en interiores y exteriores, ofreciendo comodidad, conveniencia y bienestar a los ojos. A la vez que brindan una protección ideal contra la luz azul nociva de las pantallas digitales y el sol, como fuente natural.
Muchas personas se quedan ciegas porque no saben que tienen enfermedades oculares, ya que a veces no hay señales ni síntomas de advertencia. Por este motivo, este día es sumamente significativo para tomar conciencia de que el 80% de las discapacidades visuales son evitables, de ahí la importancia de la consulta oftalmológica temprana y que la población esté informa sobre cuáles son las causas de discapacidad visual.
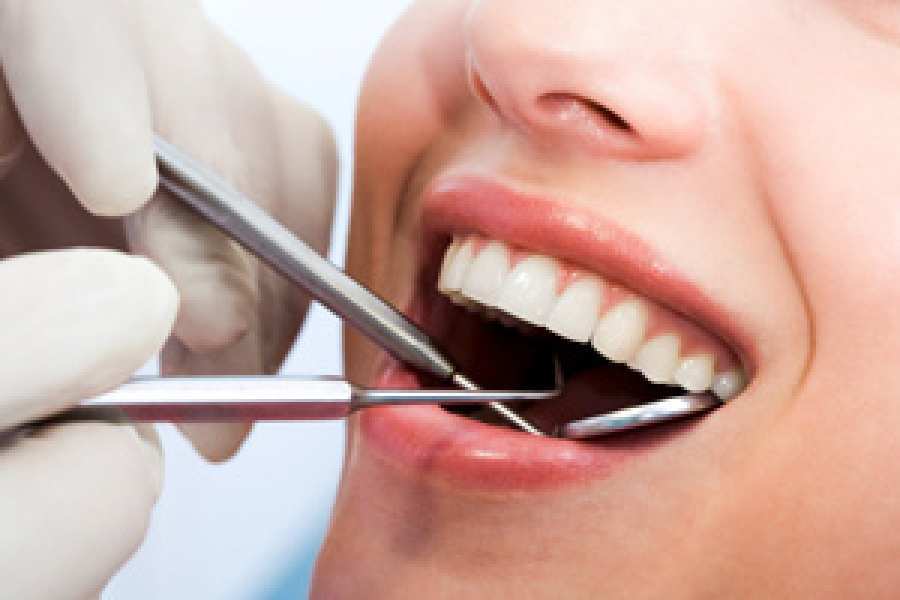
Santa Fe: un laboratorio creó un gel que permite sacar caries sin anestesia
El producto se llama Brix3000 y se comercializa en Argentina. Según indica el sitio oficial del laboratorio que lo produce, Brix Medical Science, su principio activo es la papaína, una enzima que se extrae de la cáscara de la papaya.
El producto es inocuo y de base acuosa. Actúa en dos minutos.
Cómo funciona
Primero el odontólogo aplica el gel en la cavidad cariada. Luego de dos minutos,remueve el gel, junto al tejido careado, con instrumental manual.
El producto debe aplicarse dos veces, aunque en algunos casos, según indica el sitio del laboratorio, puede que sea necesario aplicarlo más veces.
Según un estudio realizado por el propio laboratorio con 100 pacientes, el tiempo promedio de trabajo clínico en boca es de 7.5 minutos por paciente.
Contraindicaciones
El gel no causa ninguna clase de reacción alérgica. Y puede ser utilizado en mujeres embarazadas o personas con enfermedades sistémicas.
Con respecto al grado de dolor, según un estudio del propio laboratorio, el 93% de los pacientes que se sometieron a un tratamiento con el gel no presentaron ningún signo de dolor.
Fuente: La Nación
ANMAT crea un un programa de becas de investigación en ciencia reguladora
|
Disposición 10451-E/2017 – ANMAT |
| VISTO la Ley de Medicamentos Nro. 16.463, el Decreto Nro. 1490 de fecha 20 de agosto de 1992 y 1271 de fecha 29 de agosto de 2013; la Disposición ANMAT N° 4548 de fecha 1° de julio de 2014 y el Expediente N° 1-0047-0000-005083-17-4 del Registro de esta ADMINISTRACIÓN NACIONAL DE MEDICAMENTOS, ALIMENTOS Y TECNOLOGÍA MÉDICA (ANMAT), y CONSIDERANDO: Que por Decreto Nº 1490/92, se creó en el ámbito de la ex SECRETARÍA DE SALUD del MINISTERIO DE SALUD y ACCIÓN SOCIAL, esta ADMINISTRACIÓN NACIONAL DE MEDICAMENTOS, ALIMENTOS Y TECNOLOGÍA MÉDICA (ANMAT), como organismo descentralizado de la Administración Pública Nacional, con jurisdicción en todo el territorio de la Nación, asumiendo las funciones referidas al control y fiscalización sobre la sanidad y calidad de las drogas, productos químicos, reactivos, formas farmacéuticas, medicamentos, elementos de diagnóstico, materiales y tecnologíabiomédicos y todo otro producto de uso y aplicación en la medicina humana; (Artículos 2° y 3º, inciso a). Que las normas aludidas tienen como finalidad última la protección de la salud de la población, mediante la adopción de un modelo fiscalizador de gestión que destina los mayores esfuerzos a garantizar la eficacia, seguridad y calidad de los productos que consume la población. Que asimismo entre sus atribuciones se encuentra la de Implementar acciones de investigación, asistencia técnica, docencia, capacitación, promoción, comunicación, difusión y toda otra actividad orientada a prevenir y resguardar la salud de la población (Artículo 8° inciso h) Que en su artículo 10° inciso k) se estableció expresamente la facultad de programar e implementar actividades de docencia, investigación, capacitación y asistencia técnica en relación con las materias sujetas a la competencia del Organismo, así como otorgar becas para estudios, investigaciones y especializaciones. Que la investigación científica en un campo particular tiene como objetivo la generación de nuevo conocimiento, del cual se desprenden principios y leyes con capacidad predictiva, lo cual resulta esencial para la toma de decisiones en los ámbitos correspondientes. Que en una agencia reguladora la investigación científica tiene como meta desarrollar nuevos métodos, herramientas, criterios, estándares y reglamentaciones que le permitan ejercer de mejor manera sus acciones y así alcanzar con éxito sus objetivos. Que por los motivos mencionados precedentemente, la investigación que se realiza en una agencia reguladora, tiene un carácter profundamente traslacional y de alto impacto, dado que constituye una herramienta esencial para asegurar que los ciudadanos cuenten con productos eficaces, seguros y de calidad. Que dado el carácter dinámico de la generación de nuevo conocimiento en los campos ligados a la medicina y la salud humana, y en especial en el desarrollo de nuevas tecnologías, esta Administración constantemente se impone el desafío de estar al frente de tales avances, de manera de contar con herramientas útiles para ejercer sus acciones de evaluación, registro, fiscalización, control, vigilancia y normalización relativos a la producción y comercialización de estos productos innovadores, así como propiciar el desarrollo de estas nuevas tecnologías para el bienestar de la población. Que esta Administración ha sido reconocida como miembro del Comité Ejecutivo de la “Coalición Global para la Investigación en Ciencia Reguladora”, en la cual intervienen diversas agencias reguladoras de amplio reconocimiento internacional, y entre cuyos objetivos se destacan los de promover y desarrollar la investigación, apoyar la toma de decisiones regulatorias de manera global y establecer las mejores prácticas para comprender e interpretar la información acerca de las nuevas tecnologías. Que la ciencia reguladora consiste en la utilización, en cada acto decisorio, de la mejor evidencia científica disponible, como resultado de la convergencia de profesionales, académicos, reguladores y la sociedad en su conjunto. Que las normas citadas en el VISTO, hacen especial hincapié en la conveniencia y necesidad de desarrollar y promover la investigación científica en temas de relevancia para el organismo. Que el otorgamiento de becas de investigación es un sistema ampliamente extendido en nuestro país y en todo el mundo, cuyo objetivo principal es fomentar la investigación científica y apoyar la formación de jóvenes científicos. Que la creación de una beca de investigación en ciencia reguladora tiene un carácter totalmente novedoso y fomenta la formación posgrado de alta calidad en un campo aplicado de la ciencia con amplia trascendencia en salud pública. Que esta Administración, organismo nacional de referencia en la materia, constituye un ámbito altamente adecuado y propicio para el desarrollo de investigaciones de carácter regulatorio. Que desde su creación esta Administración ha ejercido un rol docente reconocido y ha contribuido ampliamente a la capacitación de posgrado. Que la creación de una “Beca de Investigación en Ciencia Reguladora” en el ámbito de esta Administración, contribuye a alcanzar ambos objetivos de propiciar la investigación regulatoria y la formación de profesionales especialistas en temáticas regulatorias relevantes. Que la Dirección de Recursos Humanos y Organización, la Dirección General de Administración y la Dirección General de Asuntos Jurídicos han tomado la intervención de su competencia. Que se actúa en ejercicio de las facultades conferidas por el Decreto Nº 1490/92 y el Decreto N° 101 de fecha del 16 de diciembre de 2015. Por ello; EL ADMINISTRADOR NACIONAL DE LA ADMINISTRACIÓN NACIONAL DE MEDICAMENTOS, ALIMENTOS Y TECNOLOGÍA MÉDICA DISPONE: ARTÍCULO 1º.- Créase en el ámbito de esta Administración Nacional de Medicamentos, Alimentos y Tecnología Médica un programa de “BECAS DE INVESTIGACIÓN EN CIENCIA REGULADORA” destinado a propiciar el desarrollo científico en el organismo y apoyar la formación profesional en áreas de investigación científica regulatoria de productos para la salud. ARTÍCULO 2°.- El desarrollo de la beca se enmarcará dentro de un proyecto de investigación con fines regulatorios, el cual se desarrollará en unidades organizativas no inferiores a direcciones de esta Administración y será responsabilidad de la autoridad máxima de dicha dirección. ARTÍCULO 3º.- La “BECA DE INVESTIGACIÓN EN CIENCIA REGULADORA” será de dos tipos, de acuerdo a los objetivos de cada proyecto: - Beca tipo A: de dos (2) años de duración, podrá extenderse por un (1) año adicional previa aprobación por parte de los responsables del programa. - Beca Tipo B: de tres (3) años de duración, podrá extenderse por dos (2) años adicionales, previa aprobación por parte de los responsables del programa. ARTÍCULO 4º.- Con el objetivo de propiciar su participación, el becario recibirá un estipendio mensual en carácter de “ayuda económica e incentivo”, cuyo monto será fijado para cada convocatoria. ARTÍCULO 5°.- La organización y supervisión general del programa de becas estará a cargo de la COORDINACIÓN DE CAPACITACIÓN E INVESTIGACIÓN CIENTÍFICA SANITARIA de la DIRECCIÓN DE RECURSOS HUMANOS Y ORGANIZACIÓN. ARTÍCULO 6°.- Apruébase el “Reglamento de la Beca de Investigación en Ciencia Reguladora”, que como Anexo I forma parte de la presente disposición y que consta como documento IF-2017-22982152- APN-DRRHHYO#ANMAT. ARTÍCULO 7°.- Apruébase el modelo de “CONVENIO anmat - becario” de la “Beca de Investigación en Ciencia Reguladora”, que como Anexo II forma parte de la presente disposición y que consta como documento IF-2017-22982037-APN-DRRHHYO#ANMAT. ARTÍCULO 8°.- Regístrese; comuníquese a la Dirección de Recursos Humanos y Organización. Dése a la Dirección Nacional del Registro Oficial para su publicación; cumplido, archívese. — Carlos Alberto Chiale. NOTA: El/los Anexo/s que integra/n este(a) Disposición se publican en la edición web del BORA -www.boletinoficial.gob.ar- y también podrán ser consultados en la Sede Central de esta Dirección Nacional (Suipacha 767 – Ciudad Autónoma de Buenos Aires). e. 11/10/2017 N° 76514/17 v. 11/10/2017 |
FDA aprueba device para apnea
Se trata de Remedē System, un dispositivo implantable que monitorea las señales respiratorias del paciente durante el sueño y estimula un nervio para mover el diafragma y restablecer la respiración normal.
El producto, que recibió el OK del organismo para ser utilizado en personas con apnea central del sueño, de moderada a severa, es implantado por un cardiólogo sin el uso de anestesia general.
Remedē System lleva la firma de la norteamericana Respicardia, una compañía enfocada en terapias cardiovasculares y respiratorias.
Fuente: Pharmabiz
Premian a investigadora argentina en EE.UU. por innovación cardiovascular
El galardón le fue otorgado por desarrollar un material biomédico con las mismas propiedades que los vasos sanguíneos.
El trabajo, titulado Injertos vasculares de pequeño diámetro antitrombogénicos biomiméticos para cirugía de bypass coronario viene desarrollándose desde hace quince años. Se centró en la generación de un conducto creado con un novedoso material biomimético, con propiedades similares a las de los vasos sanguíneos, que no produce coágulos y es reabsorbible por el cuerpo.
El nuevo material se compone de dos polímeros, el PLLA, disponible comercialmente y con características similares al colágeno, y el PHD, desarrollado en el laboratorio de Montini, similar a la elastina. El conducto diseñado está compuesto por una estructura en varias capas y con diferentes proporciones de los dos polímeros sintéticos. Con esta particularidad se reproduce las propiedades mecánicas de los vasos sanguíneos.
Otra de las características es que los polímeros se degradan sin toxicidad en el cuerpo humano, es decir que el tiempo de degradación es compatible con el tiempo de regeneración tisular, por lo que, una vez hecha la cirugía, el propio cuerpo terminaría reemplazando el conducto por tejido vascular nuevo.
“Este premio significa un gran reconocimiento al trabajo realizado no solo por mí, sino también por todos los que colaboraron. Es muy satisfactorio el reconocimiento de entidades de divulgación científica como la revista MIT Technology Review”, afirmó Montini, al tiempo que destacó que “la implementación exitosa de este proyecto genera un número de beneficios para la sociedad en general y el sector productivo porque permite el desarrollo de un injerto vascular para ingeniería de tejidos”.
Fuente: CONICET
La industria farmacéutica tiene en desarrollo más de 85 medicamentos para el Alzheimer
Algunos tratamientos ayudan a controlar la agitación, la depresión o los síntomas psicóticos (alucinaciones o delirios) que pueden ocurrir cuando la enfermedad progresa pero lo cierto es que existen pocas opciones de tratatamiento para una enfermedad que supondrá un gasto total al sistema sanitario de Estados Unidos de 259.000 millones de dólares, según el último informe publicado por la patronal de la industria farmacéutica innovadora norteamericana (PhRMA).
Actualmente, más de 5 millones de estadounidenses padecen esta enfermedad y se estima que, para 2050 podría aumentar a 16 millones si no se aportan innovaciones que avancen para prevenir o tratar la enfermedad. La mortalidad de esta patología ha aumentado un 89 por ciento desde el año 2000, mientras que las muertes por enfermedades cardiovasculares disminuyeron un 14 por ciento en el mismo periodo.
De hecho, las previsiones económicas para 2050 aseguran que, de no presentarse avances significativos, los gastos para el sistema sanitario de ese país podrían superar el billón de dólares. No obstante, si se lanzase al mercado un nuevo medicamento que muestre un retraso en la aparición de la enfermedad de cinco años los ahorros anuales para el sistema alcanzarían los 367.000 millones en costes directos e indirectos provocados por la enfermedad, tal y como indica el informe.
De este modo, la patronal asegura que las compañías biofarmacéuticas están comprometidas en combatir esta enfermedad y, de hecho, actualmente existen más de 85 medicamentos que están siendo desarrollados. “Sin embargo, la trayectoria de la investigación a una nueva medicina es extremadamente larga y compleja con muchos reveses en el camino, particularmente en el caso del Alzheimer”, explican desde la PhRMA. Y es que, aunque los científicos han hecho progresos en desentrañar las complejidades del cerebro y la identificación de los fundamentos de la enfermedad de Alzheimer, encontrar un tratamiento eficaz sigue siendo un reto de enormes proporciones.
Entre 1998 y 2014, 123 fármacos potenciales para la enfermedad de Alzheimer fueron retirados en distintas fases del desarrollo, mientras que sólo cuatro fueron aprobados por la FDA “Aunque profundamente frustrante, estos reveses de la investigación son fundamentales para avanzar en el conocimiento y sentar las bases para futuros éxitos. Mientras tanto, los investigadores biofarmacéuticos permanecen firmes en el avance de la investigación para esta devastadora enfermedad”, explican.
Los medicamentos actualmente disponibles tratan los síntomas pero no afectan las causas subyacentes de la enfermedad y no ralentizan la tasa de declinación.
De los 85 fármacos que se encuentran en desarrollo, más de 19 se encuentran en las últimas fases de desarrollo. Entre ellos, se sitúan potenciales tratamientos modificadores de la enfermedad que pueden detener o ralentizar la progresión dirigiéndose a uno o más de los cambios cerebrales causados ??por el Alzheimer.Los medicamentos potenciales también están dirigidos a disminuir la inflamación en el cerebro que se asocia con el Alzheimer y la orientación del sistema inmunológico para que pueda luchar contra la enfermedad. También están investigando maneras de prevenir la enfermedad en pacientes con mutaciones genéticas asociadas con el Alzheimer. Abbvie, Janssen, Amgen, Novartis, Merck, Boehringer Ingelheim, AstraZeneca, Lilly, Pfizer, Takeda, Sanofi o Biogen son algunas de las desarrolladoras.
Fuente: El Global.net
Una nueva técnica revoluciona el suministro de medicamentos
Investigadores de Universidad de Michigan desarrollaron una técnica que permite imprimir fármacos en dosis puras y ultra precisas en una amplia variedad de superficies. La técnica permite imprimir múltiples medicamentos en una sola dosis en una tira soluble, parche de microagujas o cualquier otro dispositivo de dosificación.
Según los investigadores, esta técnica permitirá la impresión in situ de medicamentos personalizados y dosificados, tanto en farmacias como hospitales y otros lugares.
Los investigadores dicen que esto podría hacer la vida más fácil para pacientes que deben tomar múltiples medicamentos todos los días. El trabajo también podría acelerar el desarrollo de fármacos, informa Tendencias 21.
El nuevo estudio, dirigido por Max Shtein, profesor de ciencia e ingeniería de materiales, y Olga Shalev, una estudiante de doctorado, demuestra que el medicamento impreso puro puede destruir las células cancerosas cultivadas en el laboratorio tan eficazmente como el medicamento distribuido por medios tradicionales, que se basan en solventes químicos para permitir que las células absorban el medicamento. Los resultados se publican en la revista Nature Communications.
“Un médico o farmacéutico puede elegir un número de medicamentos, que la máquina combina en una sola dosis”, dijo Shtein. “La máquina podría estar en la farmacia o incluso en una clínica.”
La técnica fue desarrollada con la tecnología de fabricación electrónica llamada “organic vapor jet printing” o impresión orgánica de inyección (OVJP), que permite imprimir una estructura cristalina muy fina sobre una superficie.
Esto ayuda a que las medicinas impresas se disuelvan más fácilmente, potencialmente abriendo la puerta a una variedad de nuevos fármacos que habían sido dejados de lado por sus problemas al ser administrados por métodos convencionales, como píldoras y cápsulas.
“Las compañías farmacéuticas tienen bibliotecas de millones de compuestos que evaluar, y una de las primeras pruebas es la de solubilidad,” dijo Shtein. “Aproximadamente la mitad de los nuevos compuestos fallan esta prueba y son descartados. La impresión de chorro de vapor orgánico podría hacer a algunos de ellos más solubles.”
Procedimiento
El proceso se inicia vaporizando el ingrediente activo de un fármaco, generalmente un polvo, y combinándolo con un gas inerte como el nitrógeno.
Los fármacos son expulsados en una superficie fría y los medicamentos se condensan en una delgada capa. La formación de la película puede ser estrechamente controlada afinando el proceso de impresión. El proceso no requiere disolventes ni aditivos.
“La impresión por inyección orgánica puede ser útil para una variedad de aplicaciones de administración de fármacos para la administración segura y eficaz de agentes terapéuticos a los tejidos diana y órganos”, dijo Geeta Mehta, co-autora del artículo.
Aunque la impresión de medicamentos en el mercado está probablemente a años de distancia, Shtein cree que la caracterización de medicinas y aplicaciones de pruebas pueden tener éxito con mayor rapidez internamente en las compañías farmacéuticas.
El equipo está explorando aplicaciones adicionales para la tecnología y planea colaborar con expertos en el diseño y la fabricación de compuestos farmacéuticos, así como con quienes trabajan en los tratamientos.
Fuente: La Razón – España
Mes rosa: campañas y actividades para la concientización sobre el cáncer de mama
Octubre es en todo el mundo el mes destinado a la sensibilización sobre el cáncer de mama. Por eso, marcas vinculadas con el universo femenino o la salud organizan para estas semanas campañas para favorecer la detección precoz, el mayor acceso a los controles y tratamientos y un acompañamiento para las mujeres que atraviesan esta enfermedad. Acá, una agenda con actividades y eventos solidarios.
Mamografías para todas. En lo que resta del año Avon en alianza con Lalcec realizará en todo el país 3.000 mamografías gratuitas a mujeres en edad de riesgo y sin cobertura médica.¡Conocé las sedes y las fechas! Además, por cada posteo con el hashtag #PoneleElPecho y una foto simulando el gesto de una heroína, la Fundación Avon donará $ 100 solventar estos estudios.
Con los controles al día. Bajo el lema “Hacete el chequeo anual. Promové el chequeo anual”, el Hospital Británico de Buenos Aires lanzará su campaña anual de concientización y prevención. Esta incluirá la realización durante octubre de 400 mamografías gratuitas para aquellas mujeres entre 40 y 70 años que no cuenten con cobertura médica. En aquellos casos en que se encuentre alguna anomalía, tendrán la posibilidad de consultar sin cargo a un médico mastólogo. En las distintas sedes de la institución. Turnos al 4309-6400 de lunes a viernes de 8 a 20. También habrá charlas gratuitas con especialistas.
Caminata en Baradero. El grupo Pelucas Solidarias Baradero hará el 7 de octubre una caminata para recaudar fondos para la instalación de una sala oncológica en el Hospital de la ciudad. A las 14, en la rotonda del puerto.
Todas en la misma. El grupo de voluntarias Enlazadas, integrado por mujeres que tuvieron cáncer de mama, hará el 7 de octubre un encuentro para pacientes y profesionales. Con charlas de nutrición y mindfulness y testimonios vivenciales. Con inscripción previa: Esta dirección de correo electrónico está siendo protegida contra los robots de spam. Necesita tener JavaScript habilitado para poder verlo.. En el auditorio del Hospital Universitario Austral (Av. J. D. Perón 1500 – Pilar), de 8,30 a 17,30.
Una mirada integral. Ese es el lema que tiene el encuentro que se hará en el Hospital Italiano. Con talleres sobre el acompañamiento a pacientes, nutrición, yoga y respiración. El 23 de octubre de 12 a 14, en Perón 4190. Además, durante este mes ofrecerán consultas gratuitas con especialistas (turnos al teléfono: 4958-4546).
La vida de los otros. Hasta el 8 de octubre se puede visitar en el Museo Fortabat una muestra de arte especial. El atractivo: diez reconocidos artistas plásticos locales plasmaron la voz de diez mujeres que, a partir de la enfermedad, transformaron sus vidas. Los artistas: Pablo Bernasconi, Federico Colletta, Pablo La Padula, Pablo León, Celeste Martinez, Nicolás Radano, Hermenegildo Sabat, Mariana Sissia, Eduardo Stupía y Mónica Van Asperen. Las obras serán subastadas a beneficio de FUCA (Fundación para la investigación, docencia y prevención del Cáncer). De martes a domingo, de 12 a 20. En Olga Cossettini 141, CABA.
A gusto frente al espejo. Este mes también habrá nuevos talleres gratuitos del programa “Luzca bien, siéntase mejor”. En los encuentros se brindan técnicas de maquillaje y belleza para seguir durante el tratamiento oncológico. Exclusivo para pacientes que no lo hayan realizado previamente. Informes e inscripción al teléfono 4813-9047, interno 21.
Tiñamos octubre de rosa. Hasta el 31, de 11 a 19, el camión de Fuca e Issue recorrerá los puntos estratégicos de la ciudad y ofrecerá a los interesados teñirse un mechón de pelo color rosa. La marca, además, propone que cada uno comparta su foto en las redes sociales con el hashtag #MeTiñoxFUCA.
Gala rosa. El 10 de octubre FUCA hará su primera gala, destinada a recaudar fondos para los programas de la entidad. A las 20,30, en el Four Seasons Hotel, Posadas 1086/88, CABA.
Qué es ETV y por qué es importante estar alerta
El estudio realizado por Kantar TNS junto a Sanofi, asegura que la totalidad de los argentinos escucharon hablar del ACV, sin embargo sólo el 25% de la población lo hicieron sobre TVP y EP y la ETV.
“La trombosis venosa profunda (TVP) es un coágulo de sangre que se forma en una vena profunda. Si el coágulo de sangre se desprende y viaja hasta los pulmones, se llama "embolia pulmonar" o "EP". Juntas, la TVP y la EP conforman la Enfermedad Tromboembólica Venosa, una afección médica peligrosa y potencialmente mortal” explica la Dra. Alicia Vilaseca, especialista en Hematología.
La ETV es una de las principales causas de muerte y discapacidad en todo el mundo. Todos los años se dan 10 millones de casos de ETV en países con ingresos altos, medios y bajos. Pero, a pesar de la gran cantidad de casos, la sensibilización pública mundial sobre la trombosis, la TVP y la EP es notoriamente más baja que la conciencia sobre otras enfermedades.
Asimismo, el informe arrojado por Kantar TNS demuestra que, en un contexto de importante dispersión de fuentes y vías de conocimiento, los medios de comunicación masivos como notas de Internet y TV son las principales fuentes de conocimiento sobre la problemática de la patología. “La experiencia de algún pariente/amigo cercano también suele acercar al paciente hacia el consultorio” agrega la Dra. Vilaseca.
Los síntomas detectables de una Trombosis Venosa Profunda son: dolor leve que comienza por lo general en la pantorrilla; seguido por la inflamación del pie, el tobillo o la pierna; cambio de color o enrojecimiento evidente de la piel y calor. Por otra parte, la Embolia Pulmonar se caracteriza por dolor de pecho, ahogo o dificultad en la respiración, frecuencia cardíaca rápida y mareos o desvanecimientos.
Sin embargo, el paciente puede no tener síntomas por lo que la prevención resulta la mejor manera de evitar este tipo de cuadros y sus complicaciones.
Prevención poco consciente
Según los resultados arrojados por el estudio, 1 de cada 6 personas considera que las enfermedades tromboembólicas se pueden prevenir, adicionalmente apenas el 17 % de la población puede identificar al menos un factor de riesgo relacionado. “La hospitalización y la inmovilización, ser fumador, ser obeso o tomar anticonceptivos orales, aumentan la posibilidad de generar trombos. Además, las operaciones son otra de las principales causas de esta problemática, sobre todo cirugías relacionadas con el cáncer, la cadera o la rodilla”3 explicó la Dra. Vilaseca. “Los medidas que pueden llevarse a cabo para prevenir la enfermedad difieren según el paciente, pero generalmente incluye medicamentos anticoagulantes. Es por ello que es fundamental comunicarse con su médico para que le advierta sobre su riesgo de desarrollar esta enfermedad y las medidas necesarias para prevenirla.
Idarucizumab, primer agente de reversión de un anticoagulante oral
Actuar de forma rápida ante situaciones de urgencia, una cirugía inmediata o un sangrado no controlado que ponga en riesgo la vida en los pacientes tratados con dabigatrán etexilato, hoy es posible.
¿La razón? Existe Idarucizumab, un novedoso fármaco de Boehringer Ingelheim que permite revertir de manera rápida y segura el efecto anticoagulante de dabigatrán en este tipo de situaciones con riesgo vital.
Idarucizumab, actúa específicamente sobre la molécula de Dabigatrán, neutralizando su efecto anticoagulante pero sin interferir en la cascada de coagulación. Esto permite que los médicos puedan centrarse en el problema médico esencial, es decir, en realizar la intervención de urgencia o controlar la hemorragia.
Dabigatrán es el primer y único anticoagulante oral de acción directa en disponer de un agente de reversión específico que permite actuar con rapidez y de manera eficaz en situaciones de emergencia.
Según el estudio clínico de fase III RE-VERSE AD, se observó una normalización inmediata de los parámetros de coagulación tras la administración de idarucizumab en más del 98% de los pacientes.
Con estos datos, la disponibilidad de un agente de reversión específico puede proporcionar una mayor confianza a médicos y a pacientes anticoagulados, aunque la previsión de uso se estima que sea poco frecuente en la práctica clínica diaria.
La Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) aprobó IDARUCIZUMAB en Argentina el 25 de abril de 2017 con la siguiente indicación:
- Praxbind® es un agente reversor específico de dabigatrán, cuyo uso está indicado en pacientes tratados con Pradaxa [dabigatrán etexilato] cuando se requiere una reversión rápida de los efectos anticoagulantes de dabigatrán:
- Para cirugías de emergencia/procedimientos de urgencia.
- En cuadros de sangrado no controlado o potencialmente fatal.
Se estima que el producto estará disponible comercialmente a finales de octubre.
Lo más visto
- Covishield, la vacuna que India lanzó con Oxford-AstraZeneca
- El gobierno establece los requisitos para la producción de cannabis medicinal
- Anmat aprobó en el país la primera vacuna que protege contra el dengue
- Comunicación de Novo Nordisk: Diferencias en la indicación de Victoza® y Saxenda®
- Ibupirac declarado apto para celíacos