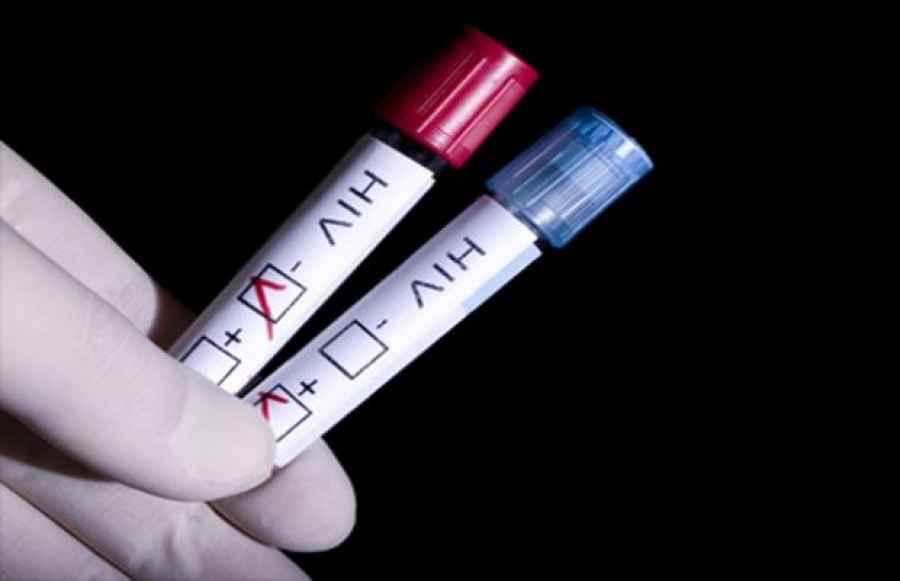
Presentan un mapa digital para realizarse test de VIH gratis en todo el país
El Ministerio de Salud de la Nación presentó un mapa digital que permite conocer la ubicación del hospital o centro de salud más próximo para hacerse el test del Virus de Inmunodeficiencia Humana (VIH) en forma gratuita, voluntaria y confidencial.
El mapa fue presentado en el marco del Día de la Promoción de la Prueba de VIH, que se celebra todos los 27 de junio, y con el objetivo de que el diagnóstico sea más accesible, ya que se estima que en la Argentina son 122 mil las personas que tienen el virus pero un 30 por ciento de ellas lo desconoce.Se trata de un trabajo realizado a partir de la recopilación de datos aportados por los diferentes programas deVIH en todo el país, a lo que se suma la información respecto de los días y horarios de funcionamiento de cada institución.Se puede acceder a esta herramienta en www.argentina.gob.ar/salud/vih-sida/donde
La prueba es la única forma en que una persona sabe si tiene VIH, además, en el caso de diagnosticarlo tempranamente, puede tener mayores posibilidades de contar con una calidad de vida óptima a partir de tratamientos que en el país son gratuitos.
La posibilidad de realizarse el test es un derecho de todas las personas, se puede acceder a él de forma gratuita en cualquier hospital o centro de salud públicos del país; es voluntario, por lo que nadie puede ser obligado a hacérselo, y es confidencial, ya que la persona que atiende no puede revelar la práctica realizada ni el resultado del diagnóstico.
Fuente: Presidencia de la Nación /COFA
Dermatitis Atópica: la segunda enfermedad de la piel más disgnosticada en el mundo
- Evitar ambientes muy calefaccionados y secos
- Evitar el uso de lana y fibras sintéticas en contacto directo con la piel, así como el abrigo excesivo
- Evitar el contacto de la piel con broches metálicos, etiquetas, goma y plásticos
- Evitar los perfumes
- Evitar la inhalación de pólenes y polvo ambiental
- Realizar baños cortos (de no más de 5 minutos) y con agua tibia
- Utilizar sustitutos del jabón de pH neutro
- Evitar la fricción de la toalla contra la piel. Se recomienda dar palmadas suaves para secar
- Hidratación: es fundamental la utilización de cremas adecuadas para mantener la piel hidratada. Si es necesario se puede aplicar varias veces al día
- Alimentación: evitar alimentos irritantes localmente como cítricos, tomate, picantes y queso de rallar cuando existe dermatitis en la cara
Cómo evitar trastornos de sueño durante los meses de invierno
Frente a la temporada más fría del año, la fisiología del sueño cambia debido a la menor cantidad de horas de luz solar, la disminución de la temperatura y el reloj biológico humano.
Bajo este contexto, Royal Philips recalca que en esta época es fundamental dormir bien y suficiente, ya que en el invierno aumenta la probabilidad de contraer enfermedades respiratorias, depresión y empeoramiento de trastornos del sueño.
Un estudio llevado a cabo por Philips - “Mejor Sueño, Mejor Salud, una mirada global sobre por qué nos estamos quedando atrás en el sueño” - estima que en Argentina el 64% de las personas padecen condiciones como insomnio, ronquidos, apnea, síndrome de piernas inquietas o narcolepsia, que impactan negativamente en el sueño.
“En América Latina, las personas están conscientes del impacto que tiene el sueño en su salud y bienestar general. Sin embargo, la mayoría apenas alcanza la cantidad de horas recomendadas, durmiendo en promedio menos de las 7 a 9 horas recomendadas por la Organización Mundial de la Salud y sin cumplir un horario fijo de sueño”, sostuvo Alina Asiminei, líder de mercado para Cuidados Respiratorios y Sueño, Philips en América Latina. “No dormir bien o lo suficiente, pueden llevar a graves trastornos de sueño que presentan un riesgo importante de salud pública en la región, por lo que es fundamental crear mayor conciencia sobre la importancia del buen dormir”.
En ese sentido, la compañía brinda consejos y tips para atravesar esta temporada de la mejor manera posible, asegurando un sueño de calidad:
-
Reducir el tiempo de la siesta durante el día. La baja temperatura y el desvelo pueden invitar a uno dormir durante el día. En caso de hacerlo, se recomienda que no dure más de media hora ya que el sueño prolongado durante el día dificulta dormir de noche e irrumpe el horario consistente de levantarse y acostarse.
-
Moderar el consumo de alimentos altos en calorías. Con bajas temperaturas ambientales el cuerpo busca de manera natural mayor ingesta de alimentos para enfrentar de mejor manera el frío. Sin embargo, esto no es bueno por la noche, debido a que una digestión pesada interfiere con la expresión normal del sueño. Además, es una de las condiciones presentes para que se dé el aumento de peso.
-
Moderar el consumo de bebidas alcohólicas. Uno de los efectos del exceso de alcohol es un sueño de mala calidad y poca profundidad.
-
Evitar el consumo de tabaco. Fumar produce irritación e inflamación de las vías respiratorias. Esto puede aumentar la posibilidad de contraer enfermedades respiratorias tal como la EPOC (enfermedad pulmonar obstructiva crónica), lo que contribuye al empeoramiento del sueño.
-
Incrementar la actividad física al aire libre. La exposición consistente a la luz de día contribuye positivamente a nuestro estado de humor y promociona un sueño nocturno de calidad.
-
Controlar la temperatura interna. El uso excesivo de la calefacción que aumenta considerablemente la temperatura puede crear un ambiente seco dentro del hogar, lo que dificulta el sueño ya que provoca que las personas respiren más por la boca, incrementando el ronquido y la posibilidad de empeorar síntomas de trastornos, tal como la apnea.
En caso de presentar síntomas persistentes que podrían ser un indicador de apnea, como dolores de cabeza e irritabilidad durante el día, o fuerte ronquido y pausas respiratorias durante el sueño, Philips recalca la importancia de acudir a un especialista para obtener un diagnóstico correcto y un curso de tratamiento adecuado.
La naturaleza crea su propio yeso para proteger las heridas de la infección
Una nueva investigación identificó la forma en que la naturaleza crea su propio yeso para tratar de evitar que las bacterias y otros microorganismos penetren en heridas abiertas. Los autores descubrieron que se forma una película de proteína rápidamente sobre una herida como parte del proceso de coagulación natural y proporciona protección durante al menos 12 horas.
Estos investigadores, una colaboración internacional de científicos liderados por la Universidad de Leeds, en Reino Unido, y financiado en parte por la ‘British Heart Foundation’, creen que esta biopelícula da tiempo al sistema inmune para ordenar sus defensas para hacer frente a cualquier infección.
Los investigadores también observaron que las sustancias a base de aceite interrumpieron el proceso y advirtieron que tratar las heridas en la piel con vaselina, una técnica utilizada en algunos deportes de contacto y después de una cirugía menor, puede aumentar el riesgo de infección.
El estudio, cuyas conclusiones se publican en ‘Journal of Clinical Investigation’, cambia la comprensión científica del mecanismo de coagulación de la sangre. La coagulación es un proceso vital para prevenir la pérdida de sangre potencialmente mortal después de una lesión. En el sitio de la herida, las plaquetas y los glóbulos rojos se agrupan para tratar de taponar cualquier hemorragia.
Mediante el uso de poderosas técnicas de imagen, los investigadores de Leeds descubrieron que las fibras de fibrina eran palancas de cambio de la naturaleza, reorganizando su estructura de una red fibrosa a una película en forma de lámina en el punto donde el coágulo entra en contacto con el aire, en el sitio de la apertura de la herida.
Visto a través de un microscopio electrónico, los coágulos parecen estar conectados entre sí por fibras parecidas a un espagueti de una proteína llamada fibrina. Durante décadas, los científicos se han sentido desconcertados acerca de la estructura precisa de las fibras de fibrina porque parecían interminables y se enroscaban alrededor de las plaquetas y los glóbulos rojos.
La investigación reveló que las fibras de fibrina se transformaron en una película protectora que tenía propiedades de “transpirabilidad”, permitiendo que el aire llegara a la herida a través de pequeños poros que eran demasiado pequeños para permitir el paso de bacterias y algunos virus. La investigación involucró tejido humano y animal.
Redefinición de la coagulación sanguínea
El profesor Robert Ariëns, del Instituto de Medicina Cardiovascular y Metabólica de Leeds, quien supervisó el estudio, subraya: “Nuestra hipótesis es que la película actúa como un yeso, una barrera protectora para tratar de evitar que los microbios entren al cuerpo donde se rompe la piel”.
“Hicimos estudios de laboratorio y en animales que demostraron que esta película podría ser una barrera contra la infección microbiana durante al menos 12 horas, y esto le da al sistema inmunitario tiempo para obtener glóbulos blancos en la herida para contrarrestar cualquier infección”, explica.
“El estudio está redefiniendo nuestra comprensión de la coagulación sanguínea. Los coágulos no solo reducen la pérdida de sangre, sino que también proporcionan una defensa de primera línea contra la infección. Entender exactamente qué sucede al final de las fibras de fibrina ha sido una pregunta que los científicos médicos han estado tratando de responder durante años. Este estudio proporciona una explicación largamente esperada”, añade.
El documento revela que los científicos que usan microscopios electrónicos habían visto previamente una película delgada sobre los coágulos, pero creían que era el resultado de la forma en que la muestra se preparó para el examen. Los investigadores también notaron que si se aplicaba aceite al coágulo perforaría la película protectora y advierten de que la práctica común de aplicar vaselina a una herida aumenta el riesgo de infección.
El profesor Jeremy Pearson, director médico asociado de la Fundación Británica del Corazón, que financió parcialmente la investigación, apunta: “Al observar cómo se forman los coágulos sanguíneos, con el objetivo de diseñar mejores fármacos anticoagulantes para tratar a pacientes con ataques cardiacos, este equipo ahora descubrió un mecanismo de protección desconocido anteriormente utilizado por nuestros cuerpos para prevenir la infección después de una lesión”.
Fuente: Europa Press /COFA
Diseñan una píldora para suministrar insulina
Dando la opción de tomar una píldora o inyectarse con una aguja, la mayoría de nosotros optaría por regular una enfermedad de salud crónica ingiriendo una pastilla. Pero para millones de personas que viven con diabetes tipo 1, una punción dolorosa con agujas una o dos veces al día es la única opción para administrar la insulina que sus cuerpos no pueden producir por sí mismos.
Ahora, investigadores de la Escuela de Ingeniería y Ciencias Aplicadas John A. Paulson de Harvard (SEAS, por sus siglas en inglés), en Estados Unidos, han desarrollado un método de administración oral que podría transformar drásticamente la forma en que los diabéticos controlan sus niveles de azúcar en la sangre.
La administración oral de insulina no solo promete mejorar la calidad de vida de hasta 40 millones de personas con diabetes tipo 1 en todo el mundo, sino que también podría mitigar muchos de los efectos secundarios que amenazan la vida de los pacientes que no se administran las inyecciones requeridas, según señalan los autores en un artículo publicado en ‘Proceedings of the National Academy of Sciences’.
La terapia con insulina, por inyección justo debajo de la piel o administrada por una bomba de insulina, generalmente mantiene los niveles de glucosa de la mayoría de los diabéticos bajo control. “Pero muchas personas no se adhieren a ese régimen debido al dolor, la fobia a las agujas y la interferencia con las actividades normales”, dice el autor principal Samir Mitragotri, profesor de Bioingeniería y profesor de Ingeniería Biológicamente Inspirada en SEAS. “Las consecuencias del control glucémico deficiente resultante pueden conducir a complicaciones graves de salud”, añade.
Encontrar una forma de administrar insulina por vía oral ha sido esquivo; a la proteína no le va bien cuando encuentra el ambiente ácido del estómago y se absorbe poco del intestino. La clave del nuevo enfoque es llevar insulina en un líquido iónico compuesto de colina y ácido geránico que luego se coloca dentro de una cápsula con un recubrimiento entérico resistente a los ácidos. La formulación es biocompatible, fácil de fabricar y puede almacenarse hasta dos meses a temperatura ambiente sin degradarse, lo que es más tiempo que algunos productos de insulina inyectables actualmente en el mercado.
Una carrera de obstáculos
“Una vez ingerida, la insulina debe atravesar una carrera de obstáculos desafiante antes de que pueda ser absorbida de manera efectiva en el torrente sanguíneo – afirma Mitragotri, también miembro del cuerpo docente del Instituto Wyss para Ingeniería Biológica Inspirada en Harvard–. Nuestro enfoque es como una navaja suiza, donde una píldora tiene herramientas para abordar cada uno de los obstáculos que se encuentra“.
Al encapsular la formulación líquida de insulina-iónica en un recubrimiento entérico, el equipo superó el primer obstáculo, resistiendo la descomposición de los ácidos gástricos en el intestino. Este recubrimiento de polímero se disuelve cuando alcanza un entorno más alcalino en el intestino delgado, donde se libera el líquido iónico que transporta la insulina.
“Cuando una molécula de proteína similar a la insulina entra en el intestino, hay muchas enzimas cuya función es degradar las proteínas en aminoácidos más pequeños”, explica la primera autora Amrita Banerjee, que realizó la investigación mientras trabajaba como investigadora postdoctoral en el laboratorio de Mitragotri y ahora es profesora asistente en la Universidad Estatal de Dakota del Norte, Estados Unidos. “Pero la insulina iónica a base de líquidos permanece estable“, añade.
La formulación de ácido colina-geránico también demostró ser capaz de penetrar dos barreras finales: la capa de moco que recubre el intestino y las uniones celulares estrechas de la pared del intestino, a través de las cuales medicamentos de moléculas grandes como la insulina no pueden pasar fácilmente.
Otros investigadores han intentado varios medios para superar estas barreras, rediseñando la molécula de insulina, recubriéndola con polímeros protectores e introduciendo aditivos para inhibir la degradación por enzimas o para mejorar la absorción. Sin embargo, actualmente no hay ningún producto de administración oral de insulina disponible en la clínica.
“Ha sido el santo grial de la administración de fármacos desarrollar formas de administrar medicamentos proteicos y peptídicos como insulina por vía oral, en lugar de inyectar”, reconoce el investigador Mark Prausnitz, presidente de Ingeniería Química y Biomolecular en el Instituto de Tecnología de Georgia.
Prausnitz, que no participó en la investigación, agrega: “Este estudio muestra resultados notables en los que la insulina administrada por vía oral en combinación con un líquido iónico funciona tan bien como una inyección convencional. Las implicaciones de este trabajo para la medicina podrían ser enormes, si los hallazgos se pueden traducir en píldoras que de manera segura y efectiva administren insulina y otros medicamentos peptídicos a los humanos“.
La insulina ingerida por vía oral sería más parecida a la forma en que el páncreas de un individuo sano produce y administra insulina al hígado, donde se extrae hasta un 80 por ciento y el resto circula por el torrente sanguíneo. También podría mitigar los efectos adversos de ponerse inyecciones durante un largo periodo de tiempo.
Banerjee también destaca que la insulina iónica líquida puede prepararse en un proceso de un solo paso que podría ampliarse fácilmente para una producción industrial económica, haciendo que el costo de fabricación de la formulación oral sea fácilmente manejable.
Fuente: Europa Press /COFA
Informe ultrarrápido de Tecnología Sanitaria: OLARATUMAB
OBJETIVO: Evaluar la eficacia y seguridad del Olaratumab en el tratamiento de pacientes adultos con sarcoma de tejidos blandos en estadío avanzado, para su registro bajo condiciones especiales.
CONCLUSIÓN: En cuanto a la supervivencia libre de progresión (SLP), variable principal del estudio, la combinación de olaratumab y doxorubicina mostró resultados superiores, con una mejoría en la mediana de 2,5 meses con respecto a la doxorubicina en monoterapia. Los pacientes con sarcoma avanzado de tejido blando tratados con monoterapia de doxorrubicina tienen una sobrevida de 12 a 16 meses después de comenzar el tratamiento. Con respecto a la superviviencia global, la combinación olaratumab y doxorubicina también demostró superioridad, mejorando la mediana de la supervivencia en 11,8 meses frente a la doxorrubicina en monoterapia. Es inesperado que la magnitud del beneficio alcanzado en la superviviencia global no vaya acompañado de un impacto aún mayor en la supervivencia libre de progresión, lo cual puede generar alguna controversia sobre la eficacia del olaratumab. Se debe tener presente que diversos factores pueden jugar a favor de estas divergencias, como ser: el azar, el pequeño tamaño muestral y la inclusión de pacientes con enfermedades heterogéneas y carentes de biomarcadores de selección molecular8 . Esta mejoría en la supervivencia de los pacientes con sarcoma avanzado no tiene precedentes, y potencialmente representa un cambio radical en su tratamiento. Se espera que el estudio fase III ANNOUNCE, aún en curso, confirme estos resultados7 .
Para ver el informe completo: OLARATUMAB
Fuente: COFA
Viperina: ¿el arma definitiva contra los virus?
La proteína viperina cataliza la síntesis de un análogo de nucleótido ‘natural’ capaz de inhibir la replicación de un gran número de virus, como el VIH, el Zika o el VHC.
Si bien en los últimos años se desarrollaron tratamientos muy eficaces frente a distintas infecciones víricas –tan solo hay que pensar en la hepatitis C–, los virus siguen siendo responsables de algunas de las enfermedades más comunes y letales de todo el planeta. Y es que a pesar de los enormes esfuerzos llevados a cabo en su investigación, hay muchos virus que parecen, simple y llanamente, ‘intratables’. Sin embargo, esta situación podría cambiar en un futuro próximo.
Y para ello, tan solo habría que fijarse en la naturaleza. De hecho, el propio cuerpo humano cuenta con una proteína que, denominada ‘viperina’, es capaz de combatir una amplia variedad de virus, incluido el virus de inmunodeficiencia humana (VIH), el de la hepatitis C, el del Zika, en del Nilo Occidental, o el de la rabia. Y ahora, investigadores de la Universidad Estatal de Pensilvania en Filadelfia (EE.UU.) han descubierto la razón para este ‘poder antiviral’ de la viperina, abriendo así la puerta al desarrollo de fármacos eficaces, por fin, frente a un gran número de virus.
Como explica Craig Cameron, director de esta investigación publicada en la revista «Nature», «ya sabíamos que la viperina tenía amplios efectos antivirales a través de algún tipo de actividad enzimática, pero otros antivirales utilizan métodos muy diferentes para combatir a los virus. Nuestro estudio muestra que la viperina cataliza una reacción importante que da lugar a la creación de una molécula llamada ‘ddhCTP’, y que esta molécula actúa sobre la capacidad del virus para replicar sus material genético. Sorprendentemente, ddhCTP actúa de manera similar a los fármacos que hemos desarrollado para tratar viruscomo el de la inmunodeficiencia humana (VIH) y el de la hepatitis C (VHC). Así, y con una mejor comprensión de cómo viperina previene la replicación viral, esperamos poder diseñar mejores fármacos antivirales».
Mirar en la Naturaleza
Cuando un virus invade una célula, utiliza sus ‘bloques de construcción’ –los consabidos ‘nucleótidos’– para replicar su material genético viral y fabricar copias con las que seguir expandiéndose por el organismo. Y aquí es donde entra en juego la molécula ddhCTP, que dado que se parece mucho a los nucleótidos es incorporada al genoma viral durante este proceso de replicación. Pero que se parezca mucho no quiere decir que sea lo mismo. Y una vez ddhCTP es añadida al genoma viral, la ARN polimerasa –la enzima encargada de replicar el material genético del virus– es incapaz de añadir más bloques. O lo que es lo mismo, no puede fabricar más copias del virus.
Como indica Craig Cameron, «hace ya tiempo, el paradigma dictaba que para matar a un virus había que eliminar la célula infectada. Un paradigma que no tiene sentido cuando el virus infecta un tipo de célula esencial con una capacidad de reemplazo limitada. Así, el desarrollo de los análogos de nucleótidos, que actúan sin tener que matar a la célula infectada, lo cambió todo».
Conocer cómo la viperina previene la replicación de los virus podría facilitar el diseño de fármacos antivirales más eficaces
Entonces, si el arsenal farmacológico ya incluye análogos de nucleótidos, ¿por qué los virus son tan difíciles de derrotar? Pues porque estos análogos son sintéticos y no funcionan ‘tan bien’ como ddhCTP.
De hecho, pueden provocar efectos secundarios muy graves, algunos letales. La razón se explica porque los nucleótidos son un tipo de ‘bloque de construcción’ que se utiliza para la ‘fabricación’ no solo del genoma, sino de la mayoría de los componentes celulares –incluidas las proteínas, caso de las enzimas–. Por ejemplo, hace unos años se diseñó un análogo de nucleótido muy prometedor para el tratamiento de la hepatitis C. ¿Y qué pasó? Pues que el análogo no solo bloqueaba la replicación del genoma del virus, sino también la producción de ARN en la mitocondria. En consecuencia, el análogo impedía la ‘fabricación’ de nuevas mitocondrias, lo que resulta fatal para las células –y por ende, para todo el organismo.
La principal diferencia entre la molécula ddhCTP y los análogos de nucleótidos es que la primera es ‘natural’, es decir, es fabricada por el organismo, mientras que los segundos son ‘sintéticos’. Y este origen natural debe cumplir un requisito fundamental: no debe ser tóxica para el organismo que la ha fabricado. Algo que aún no se ha logrado con sus homónimos ‘artificiales’.
Como refiere el director de la investigación, «al contrario de la mayoría de los fármacos actuales, ddhCTP está codificada por las células humanas y de otros mamíferos. Llevamos años diseñando análogos de nucleótidos, pero en esta situación vemos que la Naturaleza nos vuelve a vencer creando un análogo de nucleótido capaz de actuar con los virus en las células vivas y sin mostrar ninguna toxicidad. Cuando uno piensa en algo que puede funcionar, es probable que la Naturaleza ya lo haya tenido en cuenta. Tan solo se trata de encontrarlo».
Flavivirus, no picornavirus
En definitiva, la molécula ddhCTP, dado su origen natural, se presenta como el análogo nucleótido ideal. Pero, ¿realmente funciona? Pues sí, y muy bien. Los resultados mostraron que ddhCTP es muy eficaz a la hora de inhibir las ARN polimerasas, y por tanto la replicación, de distintos flavivirus, incluidas varias cepas de los virus del Nilo Occidental, del dengue y del Zika –virus este último para el que aún no hay ningún tratamiento disponible–. Sin embargo, ddhCTP no es ‘todopoderosa’ y no es capaz de inhibir las ARN polimerasas de algunos picornavirus como los rinovirus humanos –en los que se incluyen los virus causantes del resfriado común– y los poliovirus –responsables de la poliomielitis–. Por tanto, hay que seguir investigando. Y en este contexto, ddhCTP también ofrece una oportunidad única para identificar los mecanismos por los que los virus desarrollan resistencias a los fármacos –o en este caso, a la propia ddhCTP.
Como concluye Craig Cameron, «el desarrollo de resistencia a un agente antiviral siempre supone un problema. El saber por qué aparece esta resistencia, o ser capaces de prevenirla, tendrá una importancia crítica si vamos a emplear ddhCTP como una terapia de amplio espectro».
Fuente: ABC – España
El fármaco para la diabetes que esconde un secreto antienvejecimiento
Un estudio publicado en la revista Aging Cell ha demostrado, por primera vez, que la metformina, utilizada para el tratamiento de la diabetes, es capaz de regular directamente la maquinaria molecular del envejecimiento.Los investigadores, combinando tecnologías bioinformáticas basadas en inteligencia artificial y experimentos de validación en células y muestras procedentes de animales y pacientes con cáncer, han demostrado que el fármaco inhibe la demetilasa KDM6/UTX e incrementa los niveles globales de H3K27me3, una etiqueta epigenética que promueve una configuración del ADN capaz de proteger contra tumores malignos y frenar el envejecimiento.
El estudio ha sido liderado por Javier A. Menéndez, jefe del Grupo de Metabolismo y Cáncer del Programa contra la resistencia terapéutica del cáncer(Procure) del Instituto Catalán de Oncología-Idibgi de Girona, con la colaboración de la empresa Mind the Byte.
Menos riesgo de condiciones asociadas al envejecimiento
Se desconocen en detalle los mecanismos a través de los cuales la metformina ejerce sus efectos
La metformina se conoce desde hace más de 60 años y estudios observacionales han vinculado su uso en pacientes diabéticos con un riesgo más bajo de padecer condiciones médicas crónicas asociadas al envejecimiento, incluyendo enfermedades cardiovasculares, neurodegenerativas y cáncer.
El fármaco actúa suprimiendo la producción de glucosa en el hígado y aumentando la sensibilidad de los receptores celulares de la insulina. También se sabe que mejora la actividad de la enzima AMPK, capaz de simular los efectos de la restricción calórica, una de las pocas actuaciones demostradas para alargar el periodo de vida saludable y que podría explicar esta capacidad de la metformina para incrementar la longevidad en animales de laboratorio.
Sin embargo, a pesar de las numerosas evidencias epidemiológicas y experimentales que sugieren la capacidad de la metformina para retrasar la aparición de enfermedades relacionadas con el envejecimiento, aún se desconocen en detalle los mecanismos a través de los cuales ejerce sus efectos.
Los efectos protectores de la metformina, responsables de la prolongación del periodo de vida saludable, podrían no estar relacionados únicamente con su conocida actividad antidiabética o metabólica.
Efectos saludables de la metformina
Javier Menéndez explica que “el debate actual se centra en averiguar si la metformina ejerce sus efectos saludables de manera indirecta o interaccionando directamente con los propios mecanismos moleculares que regulan el envejecimiento”.
“En este escenario”, continúa el investigador, “decidimos hacer uso de tecnologías bioinformáticas basadas en la inteligencia artificial para descubrir, de manera objetiva y sistemática, nuevas posibles dianas de la metformina”.
Nuevas dianas posibles de la metformina
El uso de herramientas de software computacional permitió el descubrimiento de 41 nuevas posibles dianas de metformina. “los resultados de este estudio demuestran la utilidad de las herramientas computacionales para realizar predicciones objetivas y así acortar el tiempo y la inversión necesarios para, por ejemplo, ser capaces de asignar dianas moleculares a fármacos con actividad clínica contrastada, pero huérfanos en su mecanismo de acción, como la metformina”, señala el director científico de Mind the Byte, Melchor Sánchez-Martínez.
El fármaco permite bloquear directamente el centro activo de la enzima KDM6A/UTX y de promover la acumulación de H3K27me3 en el ADN de ratones y humanos
Una de las características del envejecimiento en las células humanas es la reducción en los niveles globales de la trimetilación en lisina 27 de la histona 3 (H3K27me3), una ‘etiqueta’ epigenética que permite que el ADN adquiera una configuración muy compacta en el núcleo de las células que se denomina heterocromatina.
La deficiencia en H3K27me3 y las consiguientes alteraciones en la estructura de la heterocromatina es una causa del envejecimiento celular, tal y como puede observarse en las personas que sufren un envejecimiento prematuro o acelerado, como el síndrome de progeria Hutchinson-Gilford o el síndromede Werner.
Enzimas modificadoras del epigenoma
“Entre las numerosas enzimas modificadoras del epigenoma que fueron predichas como dianas de la metformina en el estudio computacional aparecía KDM6A/UTX, la enzima responsable de borrar específicamente la marca H3K27me3 en nuestro genoma y cuya actividad se ve incrementada durante el envejecimiento”.
“Decidimos entonces validar experimentalmente la capacidad de la metformina para bloquear directamente a KDM6A/UTX y de promover la acumulación de H3K27me3 a nivel fisiológico”.
A través de ensayos bioquímicos, del empleo de líneas celulares de individuos con síndromes de envejecimiento acelerado y del análisis de muestras de tejidos procedentes de animales y de pacientes con cáncer tratados con dosis terapéuticas de metformina, los investigadores fueron capaces de confirmar que el fármaco permite bloquear directamente el centro activo de la enzima KDM6A/UTX y de promover la acumulación de H3K27me3 en el ADN de ratones y humanos.
Estudios en rata topo desnuda
Javier Menéndez señala que “estudios recientes con la rata topo desnuda han puesto de manifiesto que su epigenoma es extremadamente resistente debido a la acumulación de la etiqueta epigenética H3K27me3”.
“Esto plantea la interesante posibilidad de que la metformina pueda prevenir la aparición de enfermedades relacionadas con la edad al interferir directamente con la maquinaria molecular del envejecimiento y promover una estructura más estable del epigenoma humano”.
Fuente: Redacción Médica – España
Crean una piel electrónica que se estira hasta nuevos límites
Científicos de la Universidad de Ciencia y Tecnología Rey Abadalá (KAUST, por sus siglas en inglés), en Arabia Saudita, han desarrollado un hidrogel eléctricamente conductivo que lleva la elasticidad, la auto-curación y la sensibilidad a la tensión a nuevos límites. “Nuestro material supera a todos los hidrogeles previamente informados e introduce nuevas funcionalidades”, dice Husam Alshareef, profesor de Ciencia e Ingeniería de Materiales.
Los materiales inteligentes que se flexionan, sienten y se estiran como la piel tienen muchas aplicaciones en las que interactúan con el cuerpo humano. Las posibilidades van desde parches biodegradables que ayudan a sanar las heridas a dispositivos electrónicos portátiles y dispositivos robóticos sensibles al tacto.
El material es un compuesto de hidrogel que contiene agua y un compuesto de metal y carburo conocido como MXene. Además de poder estirarse en más del 3.400 por ciento, el material puede volver rápidamente a su forma original y se adherirá a muchas superficies, incluida la piel. Cuando se corta en pedazos, se puede reparar rápidamente al volver a colocarlo.
“La diferente sensibilidad del material al estiramiento y la compresión es un descubrimiento innovador que agrega una nueva dimensión a la capacidad de detección de los hidrogeles”, dice el primer autor, Yizhou Zhang, investigador postdoctoral en el laboratorio de Alshareef.
Esta nueva dimensión puede ser crucial en aplicaciones que detectan cambios en la piel y los convierten en señales electrónicas. Una delgada capa del material unida a la frente de un usuario, por ejemplo, puede distinguir entre diferentes expresiones faciales, como una sonrisa o un ceño fruncido. Esta capacidad podría permitir a los pacientes con parálisis extrema controlar equipos electrónicos y comunicarse.Las tiras del material adherido a la garganta tienen capacidades impresionantes para convertir el habla en señales electrónicas. Esto podría permitir que se escuche con claridad a las personas con dificultades de habla. “Existe un potencial real para nuestro material en diversas aplicaciones biomédicas y de biodetección”, dice el coautor Kanghyuck Lee.
Las posibilidades médicas más directas y extremadamente útiles incluyen recubrimientos flexibles para heridas que pueden liberar medicamentos para promover la cicatrización. Estos podrían aplicarse internamente, en órganos enfermos, además de adherirse externamente a la piel. El equipo también prevé desarrollar un material inteligente que pueda controlar el volumen y la forma de un órgano y variar la liberación del fármaco según con las señales producidas.
Un potencial ideal sería combinar la detección médica y la terapia. Otras posibilidades emocionantes se encuentran en la robótica, donde el material podría servir en extensiones táctiles sensibles al tacto para maquinaria, por ejemplo. También existen posibilidades de anti-falsificación, con losas del material y componentes electrónicos integrados que resultan altamente sensibles para detectar firmas tal como están escritas.
El equipo KAUST tiene una larga lista de posibles aplicaciones que ahora se pueden explorar y desarrollar más. “Existe un gran potencial para la comercialización“, concluye Alshareef.
Fuente: Europa Press
Identifican un canal iónico usado por los virus para infectar a las células
|
Un equipo de la Universidad Pompeu Fabra de Barcelona descubrió un mecanismo utilizado por los virus para infectar las células mediante la identificación de la interacción entre un canal de iones y una helicasa de ARN. El estudio abre nuevas líneas de investigación dirigidas al desarrollo de terapias para tratar las infecciones por los virus dengue, hepatitis C y zika. |
||
|
|
||
| Investigadores de la Universidad Pompeu Fabra (UPF), liderados por Miguel Ángel Valverde, han identificado un canal iónico usado por los virus para infectar a las células. El estudio ha sido publicado en Nature Communications y han participado investigadores de los laboratorios de Fisiología Molecular y Virología Molecular del Departamento de Ciencias Experimentales y de la Salud (DCEXS) de la UPF y del Departamento de Bioquímica de la Universidad Autónoma de Barcelona.
Los virus tienen una capacidad muy limitada para replicarse y dependen totalmente de las proteínas de la célula huésped para su propagación. Para infectar a las células, los virus se unen a los receptores en la superficie de las células diana, entran en estas y “secuestran” la maquinaria de la célula huésped para lograr sus propios fines. Las ARN helicasas son uno de los tipos de proteínas celulares que son ‘secuestradas’ por los virus para replicarse en el interior celular. “Nuestro estudio apunta a que un canal iónico, el TRPV4, también parece ser secuestrado por los virus en fases muy iniciales de la infección” afirma Valverde, director del Laboratorio de Fisiología Molecular de la UPF. Los canales iónicos son proteínas de la superficie celular que regulan la entrada de iones a través de las membranas celulares. El flujo de iones a través de los canales modifica las señales eléctricas en las células y provoca cambios rápidos en la concentración de segundos mensajeros intracelulares, como el calcio, que controlan diferentes funciones celulares. El Laboratorio de Fisiología Molecular ha estado estudiando estos canales iónicos, especialmente el canal de iones TRPV4, desde principios de los años 2000. El TRPV4 es un canal interesante porque responde a una gran variedad de estímulos químicos y físicos. Debido a esta variada gama de mecanismos de activación, el TRPV4 sirve como un sensor versátil que permite que las células individuales y todo el organismo detecten cambios en su entorno. El equipo dirigido por Valverde publicó recientemente la implicación de este canal en los mecanismos de defensa de las vías respiratorias. El trabajo identifica la interacción entre la helicasa del ARN DDX3X y el canal TRPV4. La DDX3X, está involucrada en casi todos los aspectos del metabolismo del ARN que ocurren tanto en el núcleo como en el citoplasma, y también es necesaria para la replicación del virus. Del mismo modo se ha demostrado que DDX3X se mueve entre el citoplasma y el núcleo, aunque los mecanismos que regulan dicho proceso no se conocen bien. La inhibición farmacológica del canal TRPV4 reduce la infección por los virus dengue, zika y el virus de la hepatitis C Detección de la presencia de proteínas virales Por lo tanto, los investigadores caracterizaron la importancia funcional de la interacción entre TRPV4 y DDX3X y si dicha interacción tenía alguna relevancia en la infección por el virus. “Ahora hemos identificado que el canal TRPV4 también es capaz de detectar la presencia de proteínas virales, lo que permite la entrada de calcio en la célula y el movimiento de DDX3X en el núcleo de la célula”, explica Pau Doñate, investigador postdoctoral en el Laboratorio de Fisiología Molecular y primer autor del artículo. Durante los últimos años virus emergentes como el dengue, zika o chikungunya, han sido responsables de inesperadas epidemias que afectan de forma marcada a la población residente en zonas endémicas. Estos virus de ARN son capaces de mutar rápidamente para adaptarse a los cambios en el medio ambiente, y así dificultan la identificación de dianas virales para el tratamiento farmacológico y el control de las epidemias. Sin embargo, como los virus dependen totalmente de las proteínas de la célula huésped para su replicación, es de vital importancia el descubrimiento de nuevas proteínas celulares y vías de señalización necesarias para la infección viral que puedan ser objetivos viables para el desarrollo de terapias. Este enfoque tiene la ventaja de dirigirse a las proteínas celulares que no están sujetas a las tasas de mutación rápidas de los genomas de virus. “Precisamente, nuestro hallazgo de que la inhibición farmacológica (o mediante técnicas genéticas) del canal TRPV4 reduce la infección por los virus dengue, zika y el virus de la hepatitis C, abre nuevas líneas de investigación sobre las posibilidades terapéuticas para abordar estas infecciones virales”, concluye Valverde. Referecia bibliográfica: P. Doñate-Macian, J. Jungfleisch, G. Pérez-Vilaró, F. Rubio-Moscardo, A. Perálvarez-Marín, J. Diez and M.A. Valverde. “The TRPV4 channel links calcium influx to DDX3X activity and viral infectivity”. Nature Communications. Junio, 2018. DOI: 10.1038/s41467-018-04776-7 Fuente: Agencia SINC – España |
Lo más visto
- Covishield, la vacuna que India lanzó con Oxford-AstraZeneca
- El gobierno establece los requisitos para la producción de cannabis medicinal
- Anmat aprobó en el país la primera vacuna que protege contra el dengue
- Comunicación de Novo Nordisk: Diferencias en la indicación de Victoza® y Saxenda®
- Ibupirac declarado apto para celíacos