Mostrando artículos por etiqueta: medicamentos
Informes de posicionamiento terapéutico de la agencia española de medicamentos
La Agencia Española de Medicamentos y Productos Sanitarios (Aemps) publicó nueve informes de posicionamiento terapéutico (IPT) correspondientes a los principios activos de tilmanocept, irinotecan liposomal pegilado, ivacaftor, canakinumab, lesinurad, sofosbuvir, rilpivirina, emtricitabina y carfilzomib.
La mayoría de estos fármacos se utilizan para el tratamiento de diferentes tipos de cáncer. Es el caso de Lymphoseek (tilmanocept), que se utiliza para la detección del ganglio centinela en cáncer de mama, melanoma o carcinoma epidermoide de la cavidad oral. Otro de los medicamentos para el cáncer evaluados ha sido el Kyprolis (carfilzomib), una combinación con lenalidomida y dexametasona autorizado en el tratamiento de pacientes adultos con mieloma múltiple que han recibido al menos un tratamiento previo. Además, el Onivyde (irinotecan liposomal pegilado) ha sido analizado por esta institución. Se trata de un fármaco utilizado en pacientes con cáncer de páncreas metastático que han progresado tras una línea previa de tratamiento con un régimen basado en gemcitabina
También ha sido evaluado Vosevi (sofosbuvir), un medicamento destinado al tratamiento de la infección crónica por el virus de la hepatitis C en adultos. En el apartado de enfermedades infecciosas se ha publicado el IPT de dos fármacos utilizados para el VIH. Por un lado se encuentra Symtuza (emtricitabina), indicado para el tratamiento de la infección por el virus de la inmunodeficiencia humana de tipo 1 (VIH-1) en adultos y adolescentes. Por otro, Odefsey (rilpivirina), un fármaco destinado al tratamiento de adultos y adolescentes (de 12 años de edad o mayores con un peso corporal de al menos 35 kg) infectados con el VIH-1 sin mutaciones conocidas asociadas con resistencia a los ITINN, tenofovir o emtricitabina.
La Aemps también ha hecho público el IPT de Orkambi (ivacaftor), autorizado en la Unión Europea para el tratamiento de pacientes con fibrosis quística, de edad igual o superior a 12 años.
En el apartado de Reumatología se han evaluado dos nuevos fármacos: el Ilaris (canakinumab), que sirve en artritis gotosa, síndromes de fiebre periódica y enfermedad de Still, y Zurampic (lesinurad), apto para , para el tratamiento adyuvante de la hiperuricemia en pacientes adultos con gota (con o sin tofos) que no han alcanzado las concentraciones séricas de ácido úrico deseadas con una dosis adecuada de un inhibidor de la xantina oxidasa en monoterapia.
Fuente: Redacción Médica – España / COFA
En la ciudad de Corrientes prohíben la venta de medicamentos en quioscos y regulan la distancia entre farmacias
El Ministerio de Salud estableció la cobertura 100% de medicamentos para reproducción asistida y límite de edad a los tratamientos
El Ministerio de Salud a través de la Resolución 1044/2018 fijó en 44 años el límite de edad para acceder a todo tratamiento de reproducción médicamente asistida con óvulos propios, salvo prescripción médica en contrario.
Todo tratamiento de reproducción médicamente asistida con óvulos donados se realizará a mujer de hasta 51 años de edad al momento de acceder a dicho tratamiento.
Estableció para el supuesto de que la mujer de entre 44 y 51 años de edad hubiera criopreservado sus propios óvulos antes de cumplir la edad de 44 años, podrá realizar cualquier tratamiento de reproducción médicamente asistida con dichos óvulos propios criopreservados.
Medicamentos 100%
| A través de la Resolución 1045/2018 estableció cobertura 100% a los medicamentos aplicados a cualquier tratamiento de reproducción médicamente asistida. | ||
|
|
||
| Ciudad de Buenos Aires, 01/06/2018VISTO el Expediente Nº EX-2018-15444955-APN-DD#MS del registro del MINISTERIO DE SALUD, la Ley Nº 26.862, el Decreto Reglamentario Nº 956/13 y la Resolución Ministerial Nº 201/2002, y,CONSIDERANDO:Que la Ley Nº 26.862 (B.O.: 26/06/2013) tiene por objeto garantizar el acceso integral a los procedimientos y técnicas médico-asistenciales de reproducción medicamente asistida, y mediante su art. 8º prescribe que todo prestador de salud, posea la figura jurídica que posea, incorporará como prestaciones obligatorias y a brindar a sus afiliados o beneficiarios, la cobertura integral e interdisciplinaria del abordaje, el diagnóstico, los medicamentos y las terapias de apoyo y los procedimientos y las técnicas que la ORGANIZACIÓN MUNDIAL DE LA SALUD (OMS) define como de reproducción médicamente asistida, no pudiéndose introducir requisitos o limitaciones que impliquen la exclusión debido a la orientación sexual o el estado civil de los destinatarios.
Que el artículo 3° de la Ley N° 26.862 dispone que la autoridad de aplicación de dicha ley es el MINISTERIO DE SALUD DE LA NACIÓN. Que la citada norma ha establecido el carácter de orden público de sus disposiciones como su aplicación en todo el territorio de la República Argentina, en concordancia y con el alcance previsto en su Decreto Reglamentario Nº 956/13 (B.O.: 23/08/2013). Que es deber de esta Cartera de Estado adoptar las medidas que correspondan para dar efectiva y plena tutela a la garantía conferida en términos generales en materia de reproducción humana asistida por un lado, y especialmente en lo que a la presente atañe, en lo que refiere a cobertura de medicamentos aplicados a la fertilización asistida. Que resulta no sólo necesario sino también oportuno y conveniente, clarificar lo establecido en el ANEXO IV de la Resolución Ministerial Nº 201/2002 (B. O.: 19/04/2002), sustituido por el artículo 4° de la Resolución Ministerial N° 310/2004, en lo que refiere a medicamentos aplicados a tratamientos de reproducción médicamente asistida, considerando lo previsto por el art. 8º de la Ley Nº 26.862 en lo que refiere a la integralidad de la cobertura allí prevista, la cual es expresamente extendida a los medicamentos aplicados en los tratamientos de reproducción humana asistida. Que a mayor abundamiento, la presente resulta coincidente con lo consensuado a este respecto en mesa de trabajo llevada a cabo por este Ministerio de fecha 16 de noviembre de 2017, en la cual sus participantes, DEFENSORÍA DEL PUEBLO DE LA NACIÓN, SUPERINTENDENCIA DE SERVICIOS DESALUD y miembros del COMITÉ ASESOR AD-HOC del PROGRAMA NACIONAL DE REPRODUCCIÓN MÉDICAMENTE ASISTIDA, consensuaron que, dado lo prescripto por la Ley Nº 26.862, la cobertura de medicamentos aplicados a la reproducción médicamente asistida es del CIENTO POR CIENTO (100%). Que el área propiciante ha tenido a la vista el acta de la mesa de trabajo llevada a cabo por este MINISTERIO de fecha 16 de noviembre de 2017 y carta de la SOCIEDAD ARGENTINA DE MEDICINA REPRODUCTIVA – SAMER – del 14 de noviembre de 2017, como así también de la documentación respaldatoria que acredita tanto las representaciones invocadas como la existencia de las personas jurídicas que representan. Que el PROGRAMA NACIONAL DE REPRODUCCIÓN MÉDICAMENTE ASISTIDA propicia la presente medida. Que la SECRETARÍA DE PROMOCIÓN DE LA SALUD, PREVENCIÓN Y CONTROL DE RIESGOS ha prestado su conformidad. Que la DIRECCIÓN GENERAL DE ASUNTOS JURÍDICOS ha tomado la intervención de su competencia. Que la presente se dicta en ejercicio de las facultades conferidas por la Ley de Ministerios, sus modificatorias y complementarias. Por ello, EL MINISTRO DE SALUD RESUELVE: ARTÍCULO 1°.- Establécese que todo medicamento aplicado a cualquier tratamiento de reproducción médicamente asistida, previsto por la Ley Nº 26.862, deberá ser brindado con cobertura al CIENTO POR CIENTO (100%) por los agentes obligados enunciados en el Artículo 8° de dicha Ley. ARTÍCULO 2º – Comuníquese, publíquese, dése a la Dirección Nacional del Registro Oficial. Cumplido, archívese. Adolfo Luis Rubinstein e. 05/06/2018 N° 39482/18 v. 05/06/2018 Fecha de publicación 05/06/2018 |
España crea InfoMEP una base de datos sobre medicamentos de alto riesgo
Como continuación y actualización de la publicación Medicamentos peligrosos. Medidas de prevención para su preparación y administración (pdf, 2,25 Mbytes) , el Instituto Nacional de Seguridad Salud y Bienestar en el Trabajo de España INSSBT publica la base de datos INFOMEP sobre dichos medicamentos en la que constan como entradas posibles: nombre del medicamento, código nacional, principio activo, grupo terapéutico y su descripción, laboratorio fabricante, motivo de peligrosidad, referencia según la lista del NIOSH, y recomendaciones para la preparación y administración. Por cualquiera de estas entradas se puede acceder a esta última información para cada uno de los más de 2.400 medicamentos/especialidades relacionadas. Igual que en el documento técnico, para la preparación de esta base de datos se ha partido de la información que periódicamente publica el NIOSH, complementada con la información disponible sobre los medicamentos usados en nuestro país, información que va a ser permanentemente actualizada con la colaboración de la Sociedad Española de Farmacia Hospitalaria.
El contenido de la base de datos es exportable, en formato Excel o CSV (Código seguro de verificación), para que cada usuario pueda ajustarla a sus propias necesidades. La publicación de esta base de datos INFOMEP es una importante novedad en el campo de la prevención de riesgos en el ámbito hospitalario.
Guía de Buenas Prácticas de Fabricación para Elaboradores, Importadores/Exportadores Medicamentos
Disposición 3602/2018
|
||
| VISTO la Ley 16.463 y los Decretos Reglamentarios Nros. 9763/64, 150/92 (T.O. 1993), la Ley N° 18.284, los Decretos Nros. 1490/92, y 341/92, la Disposición ANMAT N° 2819/04 y sus complementarias, las Disposiciones ANMAT Nros. 1149/11, 8278/11 y 7066/13 y el EX-2018-15732828-APN-ANMAT#MS del Registro de esta ADMINISTRACIÓN NACIONAL DE MEDICAMENTOS, ALIMENTOS Y TECNOLOGÍA MÉDICA; y
CONSIDERANDO: Que de conformidad con el Artículo 1º de la Ley Nº 16.463 quedan sometidos a su régimen y a los reglamentos que en su consecuencia se dicten, las actividades de importación, exportación, producción, elaboración, fraccionamiento, comercialización y depósito, en jurisdicción nacional o con destino al comercio interprovincial, de las drogas, productos químicos, reactivos, formas farmacéuticas, medicamentos, elementos de diagnóstico y todo otro producto de uso y aplicación en la medicina humana y las personas de existencia visible o ideal que intervengan en dichas actividades. Que el Artículo 1º del Decreto Nº 9763/64, reglamentario de la Ley Nº 16.463, establece que el ejercicio del poder de policía sanitaria referido a las actividades indicadas en el Artículo 1º de la Ley 16.463 y a las personas de existencia visible o ideal que intervengan en las mismas se hará efectivo por el Ministerio de Asistencia Social y Salud Pública de la Nación (hoy Ministerio de Salud): a) en la Capital Federal, territorios nacionales y lugares sujetos a la jurisdicción del Gobierno Nacional; b) en lo pertinente al tráfico o comercio entre una provincia con otra o con cualesquiera de los lugares mencionados en el inciso a); c) en lo relativo a las operaciones de importación y exportación con el extranjero; d) en todos los casos en que los gobiernos de provincia soliciten su acción dentro de los límites de sus respectivas jurisdicciones. Que por Decreto Nº 1490/92, se creó la ADMINISTRACIÓN NACIONAL DE MEDICAMENTOS, ALIMENTOS Y TECNOLOGÍA MÉDICA (ANMAT), como organismo descentralizado de la Administración Pública Nacional, con un régimen de autarquía económica y financiera, con jurisdicción en todo el territorio de la Nación, asumiendo las referidas funciones. Que el Artículo 3º del Decreto N° 1490/92 establece que “La ADMINISTRACIÓN NACIONAL DE MEDICAMENTOS, ALIMENTOS Y TECNOLOGÍA MÉDICA (ANMAT) tendrá competencia en todo lo referido a: a) el control y fiscalización sobre la sanidad y calidad de las drogas, productos químicos, reactivos, formas farmacéuticas, medicamentos, elementos de diagnóstico, materiales y tecnología biomédicos y todo otro producto de uso y aplicación en la medicina humana…. e) el contralor de las actividades, procesos y tecnologías que se realicen en función del aprovisionamiento, producción, elaboración, fraccionamiento, importación y/o exportación, depósito y comercialización de los productos, substancias, elementos y materiales consumidos o utilizados en la medicina, alimentación y cosmética humanas; f) la realización de acciones de prevención y protección de la salud de la población, que se encuadren en las materias sometidas a su competencia. Que en el inciso g) del mencionado artículo se dispuso que la ANMAT tiene competencia para “toda acción que contribuya al logro de los objetivos dirigidos a la prevención, resguardo y atención de la salud de la población que se desarrollen a través del control y fiscalización de la calidad y sanidad de los productos, sustancias, elementos y materiales que se consumen o utilizan en la medicina, alimentación y cosmética humanas, y del contralor de las actividades, procesos y tecnologías que mediaren o estuvieren comprendidos en dichas materias”. Que por el precitado decreto se estableció también que esta Administración Nacional sea el órgano de aplicación de las normas legales que rigen las materias sujetas a su competencia, las que en el futuro se sancionen y las que en uso de sus atribuciones dicten el Ministerio de Salud y Acción Social (hoy Ministerio de Salud) y la Secretaría de Salud (hoy Secretaría de Políticas, Regulación e Institutos), en referencia al ámbito de acción de la Administración (Artículo 4º). Que todo ello fue complementado con la consecuente potestad (obligación/atribución) para fiscalizar adecuada y razonablemente el cumplimiento de las normas de sanidad y calidad establecidas para los citados procesos y actividades, como así también para proceder al registro y/o autorización y/o habilitación —conforme a las disposiciones aplicables— de las personas físicas o jurídicas que intervengan en las acciones de aprovisionamiento, producción, elaboración, fraccionamiento, importación y/o exportación, depósito y comercialización de los productos mencionados, fiscalizando o supervisando la ejecución de dichas actividades (Artículo 8º, incisos l) y ll). Que la fiscalización de los establecimientos elaboradores, importadores y distribuidores de especialidades medicinales, a través de inspecciones técnicas, es un procedimiento apropiado para garantizar la calidad con que llegan al mercado los productos que elaboran, importan y distribuyen dichos establecimientos. Que la fiscalización debe cubrir aspectos relativos a condiciones de funcionamiento y sistemas de control de calidad utilizados por los establecimientos alcanzados por la normativa referida precedentemente. Que las acciones de fiscalización y control son responsabilidad de esta Administración Nacional, quien debe asegurar: a) el control de las industrias con uniformidad de criterio y b) la neutralidad, simetría y reciprocidad en el tratamiento y aplicación de las normas de regulación. Que mediante la Disposición ANMAT Nº 2819/04 se aprobaron lineamientos generales de Buenas Prácticas de Fabricación para Elaboradores, Importadores/Exportadores de medicamentos y sus Anexos integrantes. Que como consecuencia de los avances científicos y tecnológicos resulta necesario adoptar nuevos requerimientos internacionales sobre Buenas Prácticas de Fabricación de Especialidades Medicinales, tales como los aprobadas por la Organización Mundial de la Salud del año 2015, informes de la PIC’S – Pharmaceutical Inspection Cooperation Scheme – PE 009-12/2015 y ANNEXES 2017, como así también por normas de ICH – International Council for Harmonisation – e ISO -International Organization Standarization. Que el Instituto Nacional de Medicamentos y la Dirección General de Asuntos Jurídicos han tomado la intervención de su competencia. Que se actúa en virtud de las facultades conferidas por el Decreto N° 1490 de fecha 20 de agosto de 1992 y el Decreto N° 101 del 16 de diciembre de 2015. Por ello, EL ADMINISTRADOR NACIONAL DE LA ADMINISTRACIÓN NACIONAL DE MEDICAMENTOS, ALIMENTOS Y TECNOLOGÍA MÉDICA DISPONE: ARTÍCULO 1°.- Apruébanse los requerimientos denominados “Guía de Buenas Prácticas de Fabricación para Elaboradores, Importadores/Exportadores de Medicamentos de Uso Humano” que, como Anexo IF-2018-15736371-APN-ANMAT#MS, forma parte integrante de la presente disposición. ARTÍCULO 2º.- Déjanse sin efecto los Anexos I a XII de la Disposición ANMAT N° 2819/04. ARTÍCULO 3°.- Establécese que la presente disposición entrará en vigencia a los 60 (sesenta) días hábiles de su publicación en el Boletín Oficial. ARTÍCULO 4°.- Regístrese. Dése a la Dirección Nacional del Registro Oficial para su publicación. Notifíquese a las Cámaras de Especialidades Medicinales (CILFA, CAEME, COOPERALA, CAPGEN, CAPEMVeL), SAFYBI, Confederación Médica de la República Argentina (COMRA) y a la Confederación Farmacéutica Argentina (COFA). Cumplido, archívese. — Carlos Alberto Chiale. NOTA: El/los Anexo/s que integra/n este(a) Disposición se publican en la edición web del BORA -www.boletinoficial.gob.ar-. e. 18/04/2018 N° 25235/18 v. 18/04/2018 Fecha de publicación 18/04/2018 Haga click aquí para ver el anexo completo. |
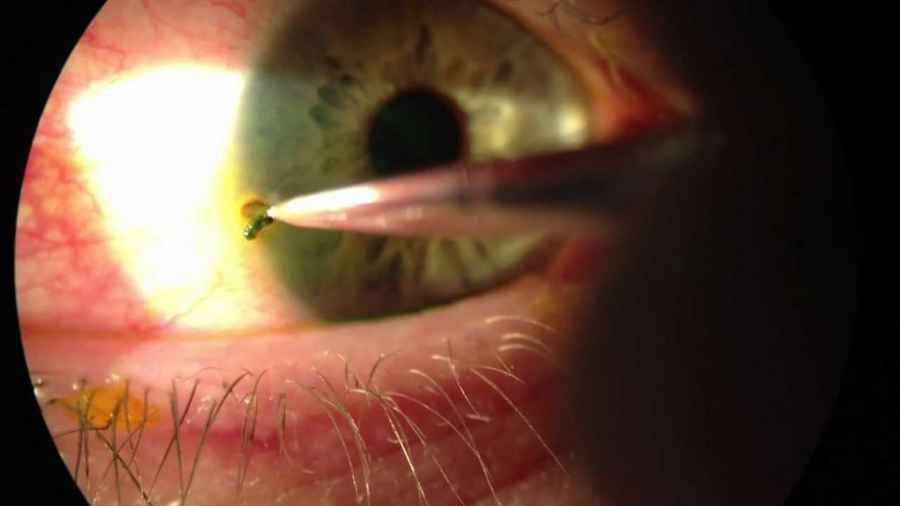
Crean un dispositivo que libera medicamentos en los ojos
|
|||
| Fuente: Clarin |
PAMI: Hubo acuerdo y bajarán los medicamentos un 5% desde abril
El PAMI confirmó anoche que hubo un entendimiento con la cámara de laboratorios nacionales (Cilfa). Aceptaron una rebaja del 5% con respecto a los valores de fines de febrero, limitarán los futuros incrementos a un 70% de la inflación durante el próximo año y establecieron "topes" en los importes a determinados remedios. Este último aspecto fue el más resistido por las firmas farmacéuticas. La medida entrará en vigencia el próximo 1° de abril.
Los laboratorios extranjeros (nucleados en Caeme) rescataban que el PAMI creaba un fondo de compensación de $ 800 millones, tal como adelantó Clarín en su edición del sábado. Pero también hay otro aspecto del convenio que la industria sigue con atención: la posibilidad de que los precios de venta al público para PAMI sean diferentes al que se apliquen para otras obras sociales.
Esa cláusula quedó en el convenio de PAMI con Caeme y Cilfa. "Será decisión de cada laboratorio si el precio de venta al público PAMI es igual o distinto del precio de venta al público aplicable al resto del mercado", establece el acuerdo rubricado entre la obra social de los jubilados y los laboratorios.
"Eso es un alivio. Que quede claro que la rebaja del 5% y los precios especiales son para PAMI. Porque si mañana me viene otra obra social y me pide las mismas condiciones, no se las voy a dar. Es un esfuerzo para el cliente más grande que tengo", graficó un ejecutivo de una empresa nacional que le había puesto luz verde al acuerdo. "Puede haber algún detalle a ajustar, pero el trazo grueso ya está definido", agregó. "Cada laboratorio deberá informar a PAMI, por mecanismos que serán detallados, cuál es precio de venta al público PAMI aplicable a la dispensa y liquidación en cada momento", reza el convenio.
"Los grandes laboratorios locales tienen operaciones afuera. Tienen que cuidar su negocio argentino, pero están más diversificados. La mayor oposición al acuerdo dentro de Cilfa viene de empresas medianas o chicas, cuya facturación sí es más dependiente del mercado argentino", detalla otro empresario que está dentro de los grandes.
El nivel de espalda financiera parece proporcional a la adherencia al acuerdo con el PAMI. Los laboratorios de mayor porte decían estar dispuestos a hacer un sacrificio, pero reconocían que había empresas más chicas que tendrían más dificultades. "Si Cilfa se resistía a firmar por la posición de esos más chicos, los hubiera entendido", justificaba a sus pares.
Los laboratorios nacionales también estaban trabajando algunos detalles diferentes al convenio del PAMI con los extranjeros. Por ejemplo, en los remedios "especiales”. El descuento en relación a los valores actuales que tendrían los argentinos sería menor que el pactado por filiales de multinacionales.
"Si quieren importar todo y fundir a las 12.000 farmacias, eso no lo vamos a avalar", destaca el empresario nacional. Entre las coincidencias que se alcanzaron está el rol de Farmalink, la empresa de los laboratorios que se encarga de la distribución de medicamentos y liquidaciones de PAMI. "Ya está aclarado que PAMI podrá ver todo lo que quiera de esa operatoria", destacan en el sector.
Uno de cada cuatro medicamentos afecta el crecimiento de las bacterias intestinales
Cada persona lleva dentro de su estómago más de un kilo de microbios que son esenciales para su salud. En los últimos años, el estudio del microbioma está encontrando cada vez más conexiones entre determinados ecosistemas bacterianos y muchas enfermedades, incluidas las mentales, aunque establecer una relación causa-efecto entre ambos no es siempre fácil.Un estudio publicado esta semana ha explorado cómo afectan al microbioma fármacos muy usados. El trabajo ha analizado el efecto de casi 1.000 medicamentos en el crecimiento de 40 variedades de bacterias que se encuentran habitualmente en el microbioma humano. Los resultados apuntan a que el 24% de los fármacos no antibióticos diseñados para tener un efecto sobre células humanas también reduce o detiene el crecimiento de una o más variedades de bacterias intestinales, en concreto 203 de los 835 analizados.
“Hemos analizado la mayoría de los fármacos más usados”, explica Lisa Maier, coautora del estudio, publicado en Nature. Los resultados muestran que entre los medicamentos que inhiben el crecimiento de las bacterias intestinales hay antipsicóticos, antihistamínicos contra la alergia, inmunosupresores, antieméticos, inhibidores de la bomba de protones como el Omeprazol, medicamentos contra el colesterol, como las estatinas, píldoras anticonceptivas y también fármacos contra la disfunción eréctil, añade la investigadora.
Estudios anteriores habían desvelado que ciertos medicamentos contra la diabetes, antiinflamatorios y antipsicóticos atípicos, cambian la composición del microbioma. El nuevo estudio es el primero que estudia las interacciones directas entre fármacos y microbioma de forma sistemática y con una mayor muestra de medicamentos, según ha explicado el Laboratorio Europeo de Biología Molecular (EMBL), en Heidelberg (Alemania), donde se ha realizado el trabajo.
El nuevo estudio es el primero que ha estudiado las interacciones directas entre fármacos y microbioma de forma sistemática y con una mayor muestra de medicamentos
En algunos casos los fármacos parecen interferir solo con una variante bacteriana y en otros con decenas de ellas. Las bacterias que son más abundantes en el intestino de personas sanas son las más afectadas por los fármacos, entre ellas especies esenciales para producir nutrientes, explica el trabajo.
Los efectos secundarios más habituales asociados a esta interacción son similares a los de los antibióticos, por ejemplo problemas gastrointestinales, señalan los autores del trabajo, aunque serán necesarios más estudios para conocerlos en detalle. El efecto de los fármacos no antibióticos en el microbioma podría explicar parte de la creciente resistencia a antibióticos, pues las bacterias parecen usar mecanismos similares para protegerse tanto de los antibióticos como de los otros fármacos, añaden los responsables del trabajo. El estudio abre la posibilidad de usar algunos de esos fármacos no antibióticos como si lo fueran, especialmente porque algunos son muy específicos contra una especie de bacteria determinada.
Los investigadores del EMBL quieren estudiar ahora cómo afectan los fármacos a comunidades enteras de bacterias intestinales. “Aún nos queda una larga investigación por delante. Es posible que en algunos casos haya un beneficio adicional porque ciertas bacterias potencian el efecto de los fármacos y que en otros disminuya la efectividad del mismo. En cualquier caso estamos tocando solo la punta del iceberg, así que es muy importante que nadie malinterprete los resultados y deje de tomar los medicamentos que le hayan prescrito”, advierte Maier. La investigadora cita un ejemplo reciente. El año pasado, un equipo internacional de científicos, entre ellos de la Universidad de Girona, demostró que la metformina, el fármaco más utilizado contra la diabetes tipo 2, hace que aumente la aparición de bacterias intestinales que reducen la intolerancia a la glucosa que caracteriza a esta enfermedad.
Rafael Cantón, jefe de microbiología del Hospital Ramón y Cajal (Madrid) y experto en resistencia microbiana, señala que “este estudio es valioso porque destapa unos efectos no desdeñables de fármacos muy usados, con lo que habrá que hacer seguimiento para conocerlos mejor”. El experto resalta que analizar estas interacciones puede ayudar a aprovecharlas en nuevos tratamientos, por ejemplo usando fármacos como coadyuvantes de los antibióticos y mejorar así su efectividad.
Fuente: El País – España
En el COFESA se propuso una política de compra conjunta de medicamentos para las provincias
En el marco de la reunión del Consejo Federal de Salud (COFESA) que se desarrolló en la ciudad de La Rioja, el ministro de Salud de la Nación, Adolfo Rubinstein, propuso a sus pares provinciales “que nos acompañen para promover una política de precios de los medicamentos y la ampliación de la cobertura”.
Rubinstein señaló que en la reunión “surgió el tema sobre cómo vamos a abordar la política de medicamentos y cómo hacer frente a los precios de los mismos que están condicionando la sustentabilidad del sistema de salud” y aseguró que “hay un contexto que se está dando que facilita que empecemos a trabajar de manera conjunta todo el sector público”.
Los ministros acordaron una futura política nacional que comprenda mecanismos de compra y negociación conjuntas transparentes y competitivas como así también la fijación de precios máximos de los medicamentos ambulatorios.
Según informó el Ministerio, los funcionarios provinciales también respaldaron la creación de la Agencia Nacional de Evaluación de Tecnologías en la que los actores presentes tendrán participación protagónica ya que son los principales actores del sistema de salud.
Rubinstein puso como ejemplo la experiencia reciente de compra consolidada del factor VIII para el tratamiento de la hemofilia en la que participó elMinisterio de Salud de la Nación, el PAMI y el IOMA “que terminó en un ahorro de 1.500 millones de pesos, un 80 por ciento de reducción en un solo medicamento”, según detalló.
En la misma línea, durante la mañana de hoy el superintendente de Servicios de Salud, Sandro Taricco, realizó una presentación que estuvo enfocada en las compras consolidadas de medicamentos. El superintendente destacó que se trata de una experiencia que les puede ser útil a las provincias ya que les permite tener “un valor de referencia y hacer ahorros importantes”.
Taricco también informó que la Superintendencia de Servicios de Salud cuenta con un observatorio de precios y agregó que con el mismo “se achicó la brecha entre los precios muy altos y los muy bajos”. Además destacó el trabajo conjunto con el Ministerio de Salud de la Nación ya que “nos permite enriquecer nuestra gestión y compartir bases de datos”.
A su turno, el titular del PAMI, Sergio Cassinotti, brindó un panorama detallado sobre el Instituto Nacional de Servicios Sociales para Jubilados y Pensionados y sobre la necesidad de hacer auditorías. “Es muy importante trabajar en compras conjuntas aunque haya algunos límites”, enfatizó.
También disertó el presidente del Consejo de Obras y Servicios Sociales Provinciales de la República Argentina (COSSPRA), Martín Baccaro.
Fuente: Ministerio de Salud de la Nación
Proponen incorporar el sistema Braille en los medicamentos
|
El legislador radical Diego Mestre, autor de la iniciativa, sostuvo que “es necesario eliminar todo tipo de barreras para que las personas con discapacidad puedan integrarse socialmente”. |
||
|
|
||
| El diputado nacional por la UCR Diego Mestre presentó un proyecto para que los medicamentos que se comercialicen tengan en su caja, embalaje o su envase una etiqueta identificadora en sistema Braille. Además, la iniciativa propone el mismo sistema para las instrucciones del uso que habitualmente acompañan al remedio.
El legislador sostuvo que “es necesario eliminar todo tipo de barreras para que las personas con discapacidad puedan integrarse socialmente” y que todos “deberíamos” ubicarnos en el lugar del otro “pensando que hay productos que llegan a personas con necesidades diferentes, pero con los mismos derechos” y que esta iniciativa busca un nuevo método de inclusión y autonomía para todos aquellos que presentan disminución visual o carencia de la misma. El cordobés recordó que según el último censo realizado en el 2010 viven en el país más de 5 millones de personas con alguna dificultad o limitación permanente, lo cual significa el 12,9 por ciento de la población y que de ese porcentaje el 59,5 por ciento padece atrofias visuales. Mestre aseguró que el proyecto pone el eje en facilitar la autonomía e inclusión de personas con discapacidad visual permitiendo el acceso a la información sobre los medicamentos que le sean recetados, pues se establece la obligatoriedad para los que lo elaboran y/o producen incorporar en su embalaje en sistema Braille “todo a los efectos de permitir su lectura y autonomía en la adquisición y aplicación”. Finalmente, el diputado radical manifestó que nuestro país debe encuadrarse dentro de las naciones que adoptan medidas de inclusión, buscando en este caso concreto que personas ciegas identificar los medicamentos que le sean prescriptos,“como ya sucede en Costa Rica desde el año 2010 o la Unión Europea que desde el 2004 obligó a sus países miembros a incorporar el sistema aquí propuesto, y Chile que ya adoptó la norma e instó a laboratorios como Bagó a incorporar paulatinamente el sistema Braille en sus remedios como sistema de identificación”, destacó. Fuente:
|
Lo más visto
- Covishield, la vacuna que India lanzó con Oxford-AstraZeneca
- El gobierno establece los requisitos para la producción de cannabis medicinal
- Anmat aprobó en el país la primera vacuna que protege contra el dengue
- Comunicación de Novo Nordisk: Diferencias en la indicación de Victoza® y Saxenda®
- Ibupirac declarado apto para celíacos