Mostrando artículos por etiqueta: dispositivo
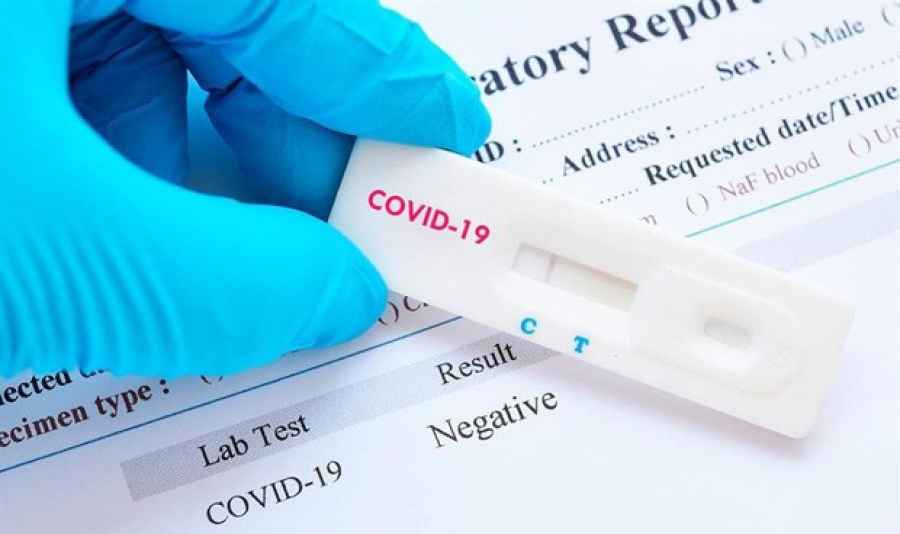
Primer dispositivo que detecta el Covid-19 a través de la coagulación
La Administración de Medicamentos y Alimentos de Estados Unidos (FDA, por sus siglas en inglés) ha autorizado, para su uso de emergencia, el primer dispositivo de detección sin diagnóstico de Covid-19. Este aparato, conocido como Tiger Tech Covid Plus, es capaz de identificar ciertos biomarcadores que pueden ser indicativos de una infección por SARS-CoV-2.
Este dispositivo está ideado para que sea utilizado por personal cualificado que pueda interpretar correctamente la información que ofrece sobre biomarcadores de la coagulación sanguínea. Los expertos de la FDA afirman que su uso complementaría la toma de temperatura que se realizada en algunos centros e instituciones para detectar, sobre todo, casos de pacientes asintomáticos.
Identificar positivos para reducir la propagación Covid
El Tiger Tech Covid Plus es un brazalete que tiene sensores de luz y un procesador integrado. Este se coloca sobre el brazo izquierdo por encima del codo para obtener datos sobre el flujo sanguíneo del paciente. Una vez completada la medición, el procesador proporciona datos sobre la coagulación en sangre, un dato que serviría para ver si se hay hipercoagulación, una anomalía muy común en los pacientes Covid.
Jeff Shuren, director del Centro de Dispositivos y Salud Radiológica de la FDA, afirma que la combinación del uso de este nuevo dispositivo de detección, que puede indicar la presencia de ciertos biomarcadores, con controles de temperatura podría ayudar a identificar a las personas que pueden estar infectadas con el virus, ayudando así a reducir la propagación de Covid-19 en una amplia variedad de entornos públicos , incluidas las instalaciones sanitarias, las escuelas, los lugares de trabajo, los parques temáticos, los estadios y los aeropuertos .
Alto porcentaje de eficacia
El estudio sobre este dispositivo se llevó a cabo entornos hospitalarios y centros escolares. En ambos sitios dio resultados muy similares, demostrando que este aparato tenía un porcentaje de concordancia positiva (proporción de individuos positivos de Covid-19 identificados correctamente por el dispositivo) del 98,6 por ciento y un porcentaje de concordancia negativo (proporción de los individuos negativos Covid-19 identificados correctamente por el dispositivo) del 94,5 por ciento.
Aun así, desde la FDA señalan que este monitor no es un dispositivo de diagnóstico y no debe usarse para diagnosticar o excluir una infección por SARS-CoV-2. El dispositivo está diseñado para su uso en personas sin fiebre y como complemento en la detección de la enfermedad.
Diseñan un test de detección de Covid-19 similar al de alcoholemia
El frotis nasofaríngeo para prueba de coronavirus es un procedimiento que consiste en introducir un largo hisopo por la nariz para recoger una muestra de la parte posterior de la nariz y la garganta, que luego se analiza para detectar el ARN del SARS-CoV-2 mediante PCR. Ahora, los investigadores que informan han desarrollado un prototipo de dispositivo que detecta de forma no invasiva el COVID-19 en el aliento exhalado de los pacientes infectados.
Además de ser incómodo, el estándar actual para las pruebas de COVID-19 requiere PCR, un procedimiento de laboratorio que requiere mucho tiempo. Debido a los retrasos, la obtención de un resultado puede llevar varios días. Para reducir las tasas de transmisión y mortalidad, los sistemas de salud necesitan pruebas rápidas, baratas y fáciles de usar.
Los investigadores crearon un conjunto de nanopartículas de oro vinculadas a moléculas que son sensibles a varios COV. Cuando los COV interactúan con las moléculas de una nanopartícula, la resistencia eléctrica cambia. Los investigadores entrenaron el sensor para detectar COVID-19 mediante el uso de «machine learning» para comparar el patrón de señales de resistencia eléctrica obtenidas de la respiración de 49 pacientes con COVID-19 confirmados con los de 58 controles sanos y 33 pacientes con infección pulmonar sin COVID en Wuhan.
Cada participante del estudio sopló en el dispositivo durante 2-3 segundos desde una distancia de 1-2 cm. Una vez que la máquina de aprendizaje identificó una posible firma de COVID-19, el equipo probó la precisión del dispositivo en un subconjunto de participantes. En el conjunto de pruebas, el dispositivo mostró una precisión del 76 por ciento en la distinción de los casos de COVID-19 de los controles y un 95 por ciento de precisión en la discriminación de los casos de COVID-19 de las infecciones pulmonares.
El sensor también pudo distinguir, con una precisión del 88 por ciento, entre pacientes enfermos y recuperados de COVID-19. Aunque la prueba necesita ser validada en más pacientes, podría ser útil para examinar grandes poblaciones para determinar qué individuos necesitan más pruebas, dicen los investigadores.
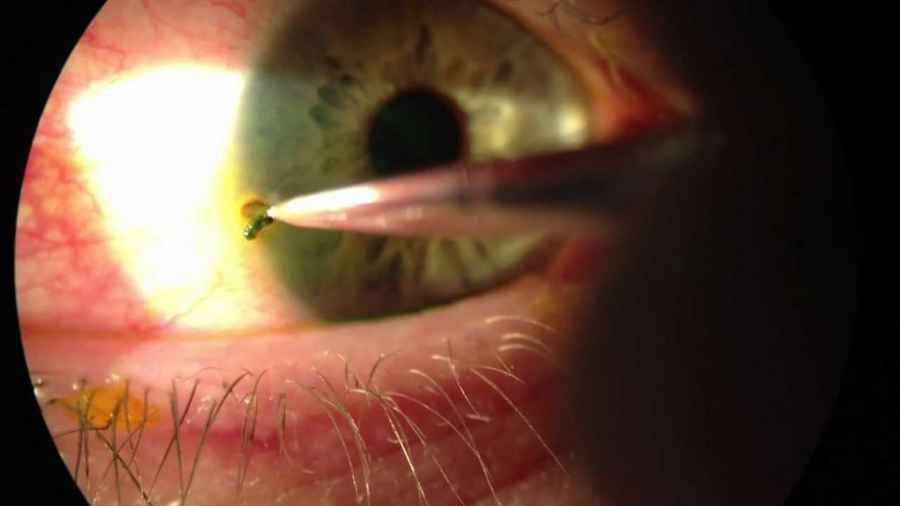
Crean un dispositivo que libera medicamentos en los ojos
|
|||
| Fuente: Clarin |
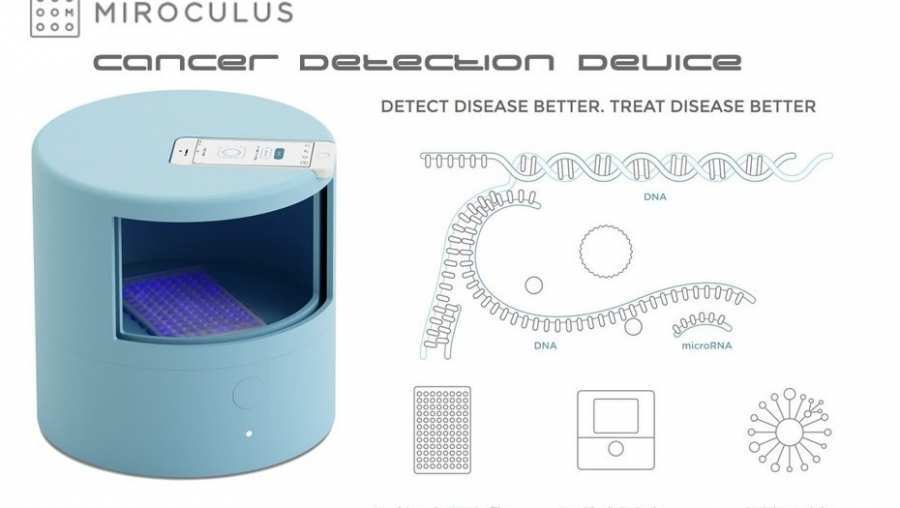
Desarrollan un chip que ayuda a detectar el cáncer de estómago
Un chip que contiene un laboratorio completo para realizar diagnósticos moleculares sobre cáncer de estómago fue desarrollado por el mexicano Jorge Soto, un proyecto que utiliza la tecnología para democratizar el acceso a la salud.
Soto, es cofundador y director de tecnología de Miroculus, una empresa de biotecnología con sede en Sillincon Valley, que tiene como gran objetivo "democratizar la detección del cáncer".
Esto significa que "se pueda detectar más temprano el cáncer y que más personas accedan a la prueba y puedan atenderse mejor", detalló el ingeniero a Télam.
La novedosa prueba que usa tecnología llamada Microfluido Digital, la están aplicando a cáncer de estómago "uno de los mas mortales en la región, pero vamos a enfocarnos en todos", explicó el profesional.
"Hoy en día la gente llega a realizarse la prueba con síntomas muy avanzados. Los sistemas de salud de nuestros países, normalmente, son públicos, y con tiempos de espera muy largos, entonces lo que hacemos es que sea fácil de monitorear y tener un diagnóstico con una prueba de sangre", detalló el ingeniero electrónico.
Actualmente "si se hace una prueba de mutación del gen que provoca, por ejemplo, cáncer en las mamás, se saca sangre que no puede analizarse en países de América Latina. El estudio se hace en España o Estados Unidos. El científico extrae el ADN, lo compara con otras enzimas y procesa los resultados".
Ante este contexto, Soto y sus socios desarrollaron un chip "que contiene un laboratorio. Allí se pone la sangre a analizar que automáticamente se mezcla con las enzimas. Tiene una zona de calentamiento, otra de óptica, y otra de magneto,es decir, todo lo que necesita un científico en un laboratorio de medio millón de dólares".
Con el chip "está todo automatizado y la respuesta lleva un par de horas", destacó el desarrollador.
"El proyecto es hacerlo fácil y accesible, es decir, que no requiera expertise técnica ni de presupuestos limitantes. Es una aparato con cartuchos muy baratos", comentó el profesional.
MIroculus ya realizó estudios clínicos en México, Guatemala, Chile y varios países de Europa "donde demostramos que podemos detectar cáncer de estómago. El año que viene queremos traerlos a estos países y capacitar al personal que lo utilizará", anticipó Soto.
(Fuente: Télam)
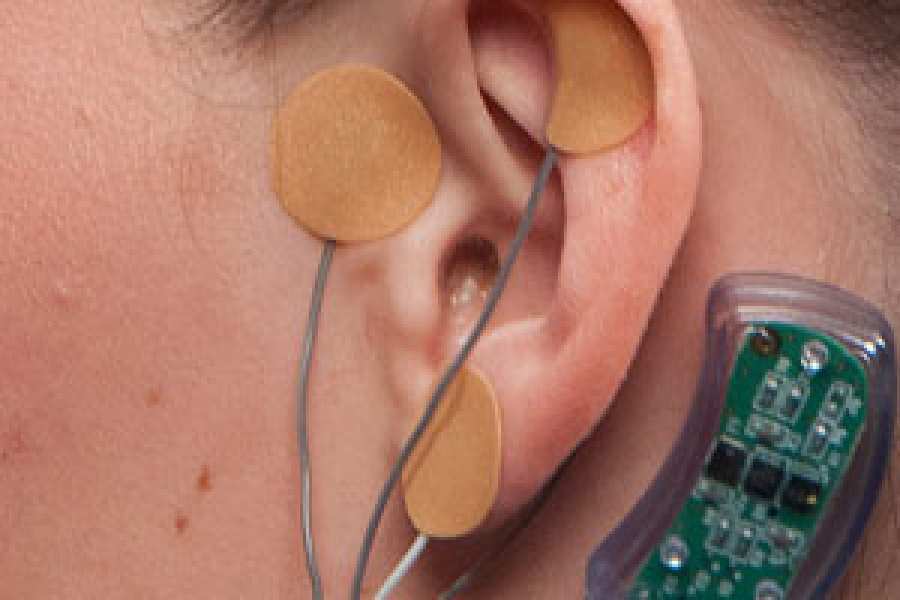
Dispositivo reduce síntomas de abstinencia a opiáceos
Con la aprobación de su nueva indicación, el dispositivo de estimulación eléctrica NSS-2 Bridge de Innovative Health Solutions se puede utilizar en pacientes hasta por 5 días durante la fase de abstinencia física aguda, para aliviar los síntomas como sudoración, malestar gastrointestinal y agitación, insomnio y dolor en las articulaciones. El dispositivo es un pequeño estimulador eléctrico de nervios que se coloca detrás de la oreja del paciente y emite pulsos eléctricos para estimular las ramas de ciertos nervios craneales.
La aprobación se basa en datos de un estudio clínico de rama única revisada por la FDA. En el estudio, se evaluaron 73 pacientes sometidos a abstinencia física de opioides en función de su escala clínica de abstinencia de opiáceos (COWS). COWS es una evaluación clínica que mide los síntomas de abstinencia de opioides, como la frecuencia de pulso en reposo, sudoración, tamaño de la pupila, problemas gastrointestinales, dolor de huesos y articulaciones, temblores y ansiedad. Las puntuaciones oscilan entre 0 y más de 36, y las puntuaciones más altas representan síntomas más graves.
El puntaje promedio de COWS para los pacientes en el estudio antes de usar el dispositivo fue 20.1. Dentro de los 30 minutos de usar el dispositivo, los pacientes mostraron una reducción en los COWS de al menos 31%. El ochenta y ocho por ciento de los participantes en el ensayo cambiaron a terapia asistida con medicación después de 5 días de usar el dispositivo, junto con los medicamentos necesarios para síntomas persistentes, como náuseas y vómitos.
Este dispositivo ya fue aprobado por la FDA en 2014 para el uso en acupuntura.
Referencias
FDA grants marketing authorization of the first device for use in helping to reduce the symptoms of opioid withdrawal [news release]. FDA’s website. https://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm585271.htm?utm_campaign=11152017_PR_FDA%20allows%20marketing%20of%20opioid%20withdrawal%20device&utm_medium=email&utm_source=Eloqua.
Lo más visto
- Covishield, la vacuna que India lanzó con Oxford-AstraZeneca
- El gobierno establece los requisitos para la producción de cannabis medicinal
- Anmat aprobó en el país la primera vacuna que protege contra el dengue
- Comunicación de Novo Nordisk: Diferencias en la indicación de Victoza® y Saxenda®
- Ibupirac declarado apto para celíacos